Pour les patients âgés de 9 mois et plus
Le seul vaccin contre la fièvre jaune disponible au Canada*
YF-VAXMD est indiqué pour l’immunisation active des personnes âgées de 9 mois et plus pour la prévention de la fièvre jaune. Il est indiqué pour la vaccination primaire et de rappel1.
La vaccination contre la fièvre jaune est conseillée pour les voyageurs qui se rendent ou résident dans des pays d’Afrique, d’Amérique centrale et d’Amérique du Sud où une infection par la fièvre jaune est officiellement déclarée. Elle est également recommandée pour les voyages en dehors des zones urbaines dans les pays qui ne déclarent pas officiellement la fièvre jaune, mais qui sont situés dans les « zones d’endémie » de la fièvre jaune1.
Personnel de laboratoire : le personnel de laboratoire susceptible d’être exposé au virus virulent de la fièvre jaune ou à des préparations concentrées de la souche 17D du vaccin par contact direct ou indirect ou encore par aérosol doit également être vacciné1.
Personnes âgées de ≥ 60 ans : la vaccination primaire contre la fièvre jaune doit être envisagée chez les personnes âgées de 60 ans et plus uniquement si les déplacements vers des régions où la fièvre jaune est considérée comme endémique ou les arrêts transitoires ne peuvent pas être évités et qu’un niveau élevé de protection contre l’exposition aux moustiques n’est pas possible. Lorsque la vaccination des personnes de plus de 60 ans est jugée nécessaire, une évaluation des risques individuels et de l’état de santé doit être effectuée avant la vaccination. De plus, les personnes âgées que l’on vaccine doivent faire l’objet d’une surveillance attentive afin de détecter d’éventuels effets indésirables pendant les 10 jours qui suivent la vaccination1,2.
À propos de YF-VAXMD
YF-VAXMD est un vaccin lyophilisé vivant atténué fabriqué en cultivant la souche 17D-204 du virus de la fièvre jaune dans des embryons de poulet vivants exempts de virus de leucose aviaire (VLA). YF-VAXMD est conforme aux normes de vaccination contre la fièvre jaune de l’Organisation mondiale de la Santé (OMS)1.
La vaccination contre la fièvre jaune est exigée par la loi pour pouvoir entrer dans certains pays, quel que soit le pays d’origine du voyageur, ainsi que dans d’autres pays, pour les voyageurs en provenance de zones d’endémie. Dans certains cas, le vaccin contre la fièvre jaune est recommandé, même s’il n’est pas exigé par la loi, p. ex., quand des cas de fièvre jaune ont été signalés dans le pays de destination. Certains pays asiatiques et d’autres pays tropicaux où la fièvre jaune ne sévit pas, mais où le moustique qui lui sert de vecteur existe, exigent que les personnes qui viennent d’un pays où cette maladie est endémique soient vaccinées afin d’éviter d’introduire la maladie sur leur territoire. On peut obtenir des renseignements à jour sur les pays qui exigent le certificat international de vaccination ou de prophylaxie auprès des services de santé locaux ou sur le site Web du Programme de médecine des voyages de l’Agence de santé publique du Canada (ASPC)1.
Pour se conformer aux règlements relatifs aux vaccins et être officiellement reconnus, seuls les centres désignés de vaccination contre la fièvre jaune approuvés par l’ASPC et enregistrés auprès de l’Organisation mondiale de la Santé (OMS) peuvent effectuer une vaccination contre la fièvre jaune, qui est ensuite enregistrée sur un certificat international de vaccination ou de prophylaxie validé de manière appropriée1. Le certificat devient valide 10 jours après avoir reçu le vaccin. Le certificat est valide « pour la vie de la personne ayant reçu le vaccin »3.
Formes posologiques et ingrédients
YF-VAXMD est présenté sous la forme d’une poudre stérile lyophilisée dans une fiole contenant une dose unique et est fourni avec le diluant correspondant. Le vaccin est disponible sous la forme suivante :
- 5 fioles à dose unique du vaccin et 5 fioles de 0,6 mL de diluant
Le vaccin doit être reconstitué immédiatement avant l’usage avec le diluant stérile fourni.
Chaque dose unique (0,5 mL) est préparée de façon à contenir :
Ingrédients non médicinaux :
Excipients :
- < 7,5 mg de sorbitol
- < 7,5 mg de gélatine
Diluant :
- 0,9 % de chlorure de sodium injectable USP (solution saline ordinaire)
Réponse d’immunogénicité démontrée pour YF-VAXMD1
Dans des études menées à travers le monde depuis 1962, utilisant des vaccins 17D chez 2 529 adultes et 991 nourrissons et enfants, les taux de séroconversion se situaient entre 91 % et 100 % dans toutes les études, sauf deux, et n’étaient jamais inférieurs à 81 %.
Dans un essai clinique randomisé comparatif à double insu mené en 2001, YF-VAXMD a été utilisé comme vaccin témoin par rapport à un autre vaccin 17D-204. YF-VAXMD a été administré à 725 adultes âgés de 18 ans et plus, dont l’âge moyen était de 38 ans, et 312 sujets ayant reçu YF-VAXMD ont fait l’objet d’une évaluation sérologique. Un logarithme de l’indice de neutralisation (LIN) de 0,7 ou plus était considéré comme une preuve de séroconversion.
Un mois après l’immunisation, 99,3 % des sujets avaient obtenu une séroconversion avec un LIN moyen de 2,21.
Les résultats d’un essai clinique portant sur 33 adultes séropositifs pour le VIH révèlent que le taux de séroconversion au vaccin 17D-204 peut être réduit chez ces patients.
Posologie et administration
Le vaccin YF-VAXMD doit être administré par voie sous-cutanée en une seule injection d’une dose.
Adultes et enfants âgés de 9 mois et plus

Les rappels augmentent le taux d’anticorps; toutefois, plusieurs études laissent croire que l’immunité conférée par le vaccin contre la fièvre jaune dure de 30 à 35 ans au moins, et probablement toute la vie.
Étapes pour l’injection
- Avant d’administrer le produit, vérifier s’il contient des particules en suspension et/ou s’il a changé de couleur. Si tel est le cas, ne pas l’utiliser.
- Reconstituer le vaccin en utilisant uniquement le diluant fourni. Prélever toute la quantité de diluant à l’aide d’une seringue du volume approprié. Injecter lentement le diluant dans la fiole renfermant le vaccin lyophilisé; laisser reposer une minute ou deux, puis remuer doucement, en imprimant un mouvement circulaire à la fiole, jusqu’à ce que la suspension soit homogène. Éviter de secouer vigoureusement.
- Utiliser le vaccin dans les 60 minutes qui suivent sa reconstitution.
- Bien remuer la fiole de produit avant de prélever la dose.
- Aspirer la dose de vaccin reconstitué nécessaire (0,5 mL) dans la seringue.
- Utiliser une technique aseptique. Utiliser une aiguille et une seringue stériles distinctes (ou une seringue stérile préremplie) pour chaque patient individuel. Ne pas remettre les capuchons sur les aiguilles, et se débarrasser de ces dernières conformément aux lignes directrices applicables aux déchets biologiques dangereux.
- Il est nécessaire de nettoyer la peau du site d’injection au moyen d’un germicide approprié avant l’injection. Si on utilise un agent de ce type à cette fin, laisser sécher complètement la peau avant d’administrer le vaccin pour prévenir l’inactivation de ce produit par l’antiseptique.
- Administrer l’intégralité du volume de 0,5 mL par voie sous-cutanée.
- Remettre un carnet de vaccination personnel permanent au patient et inscrire les antécédents d’immunisation dans le dossier médical permanent de chaque patient. Cela doit contenir le nom du vaccin, la date de son administration, la dose, le fabricant et le numéro du lot.
Veuillez consulter la monographie du produit pour connaître les instructions complètes sur la posologie et l’administration.
Profil d’innocuité
Les réactions indésirables aux vaccins 17D contre la fièvre jaune étaient généralement légères.
- Après la vaccination, 2 à 5 % des sujets éprouvent de légers maux de tête, des douleurs musculaires, une faible fièvre ou d’autres symptômes mineurs pendant 5 à 10 jours.
- Moins de 0,2 % des sujets vaccinés ont dû interrompre leurs activités habituelles.
Effets indésirables associés à l’YF-VAXMD observés dans un essai clinique randomisé comparatif à double insu mené en 2001 par rapport à un autre vaccin 17D-204 chez des adultes âgés de ≥ 18 ans (N = 725)
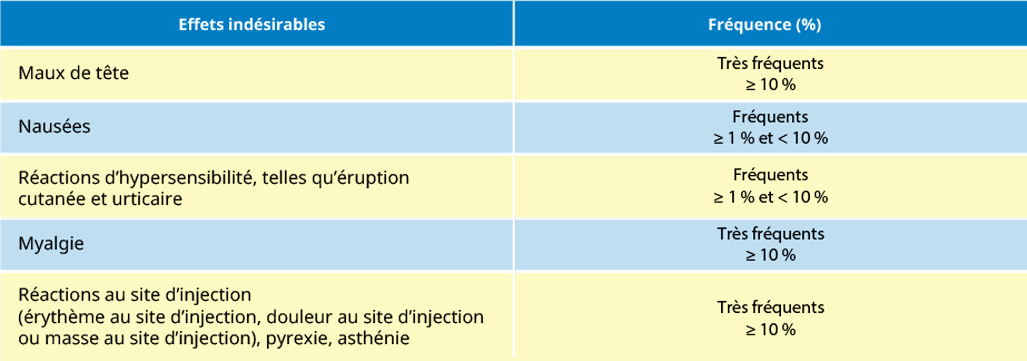
Pour obtenir une liste complète des effets indésirables, veuillez consulter la monographie de produit de YF-VAXMD.
Ressources
Renseignements relatifs à l’innocuité
Contre-indications :
- Ne doit pas être administré à une personne présentant une réaction d’hypersensibilité systémique connue à tout composant du vaccin, y compris les protéines d’œuf, ou de son contenant, ou une réaction potentiellement mortelle après l’administration antérieure du vaccin ou d’un vaccin contenant des composants similaires.
- Les personnes atteintes d’une déficience immunitaire congénitale ou acquise affectant l’immunité cellulaire (y compris les personnes qui prennent des traitements immunosuppresseurs ou celles qui présentent une immunosuppression en association avec le SIDA ou d’autres manifestations du VIH, de la leucémie, d’un lymphome, de la maladie thymique ou d’une tumeur maligne généralisée) ne doivent pas être vaccinées en raison du risque d’encéphalite.
- D’autres moyens de prévention doivent être envisagés chez les personnes atteintes d’un dysfonctionnement du thymus, car des données probantes indiquent qu’il s’agit d’un facteur de risque indépendant d’apparition de la maladie viscérotrope associée à la vaccination contre la fièvre jaune.
- La vaccination est contre-indiquée aux nourrissons âgés de moins de 9 mois en raison de l’augmentation du risque d’encéphalite. Dans la mesure du possible, on évitera de faire voyager d’aussi jeunes enfants dans les régions rurales où la fièvre jaune est endémique ou dans les pays où sévit une épidémie.
Mises en garde et précautions pertinentes :
- Des cas de syncope ont été signalés.
- Ne pas administrer par injection intravasculaire, intradermique ou intramusculaire.
- Il ne convient pas de vacciner les personnes ayant une maladie grave fébrile ou aiguë avant que les symptômes ne se soient atténués.
- Des cas isolés de maladies viscérotropes associées à la vaccination contre la fièvre jaune ont été signalés dans les 10 jours qui suivaient la vaccination. Le risque semble plus élevé à partir de l’âge de 60 ans.
- Risque de réactions anaphylactiques.
- Il se peut que les personnes immunocompromises n’obtiennent pas la réponse immunitaire attendue.
- Des cas isolés de syndrome neurotropique associé au vaccin contre la fièvre jaune ont été signalés dans le mois suivant la vaccination.
- Administrer le vaccin YF-VAXMD pendant la grossesse seulement si l’on estime que les bienfaits de la prévention de la maladie l’emportent sur les risques associés au vaccin.
- Il faut éviter dans toute la mesure du possible de vacciner les femmes qui allaitent.
Pour de plus amples renseignements :
Consultez la monographie du produit pour obtenir des renseignements importants qui n’ont pas été discutés dans ce document en ce qui concerne les effets indésirables, les interactions médicamenteuses et la posologie. Il est aussi possible d’obtenir la Monographie du Produit auprès de notre service médical. Appelez-nous au 1 888 621-1146.
* La signification clinique est inconnue.
- Monographie de produit : YF-VAXMD. Sanofi Pasteur Limitée. 17 avril 2019.
- National Advisory Committee on Immunization. Yellow fever vaccine: Canadian immunization guide. Mars 2023. https://www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-part-4-active-vaccines/page-25-yellow-fever-vaccine.html.
- Agence de la santé publique du Canada. Les voyageurs qui se rendent dans un endroit où il existe un risque de transmission de la fièvre jaune. 18 janvier 2024. https://www.canada.ca/fr/sante-publique/services/sante-voyageurs/fievre-jaune/voyageurs-rendent-endroit-existe-risque-transmission-fievre-jaune.html
MAT-CA-2201095-v1.0-05/2025






.jpg/jcr:content/image%20(2).jpg)
.jpg/jcr:content/image%20(3).jpg)
.jpg/jcr:content/image%20(1).jpg)