AVAXIMMD
Pour les patients âgés de 12 ans et plus
Un vaccin contre l’hépatite A pour les enfants (≥ 12 ans) et les adultes
AVAXIMMD est indiqué pour une immunisation active contre l’infection causée par le virus de l’hépatite A (VHA) chez les personnes âgées de 12 ans et plus. AVAXIMMD peut être utilisé pour une première vaccination ou une vaccination de rappel à la suite d’une primovaccination avec AVAXIMMD ou d’autres vaccins similaires contre l’hépatite A1.
À propos d’AVAXIMMD
AVAXIMMD confère l’immunité contre l’infection par le VHA en induisant la production d’anticorps spécifiques anti-VHA.*
Formes posologiques et ingrédients

AVAXIMMD est offert en seringues préremplies à dose unique.
Le vaccin est présenté dans des boîtes de :
- Une seringue de 0,5 mL (dose unique) avec une aiguille (1 x 25G x 25 mm).

Chaque dose de 0,5 mL est formulée pour contenir 160 unités d’antigène (U) de VHA inactivé (souche GBM).
Ingrédients non médicinaux :
2-phénoxyéthanol
hydroxyde d’aluminium (exprimé sous forme d’aluminium)
éthanol anhydre
formaldéhyde
Milieu 199 de Hanks
Résidus du processus de fabrication : néomycine
Conception de l’essai et caractéristiques démographiques de l’étude
Résumé des données démographiques et de la méthodologie des essais consacrés à AVAXIMMD
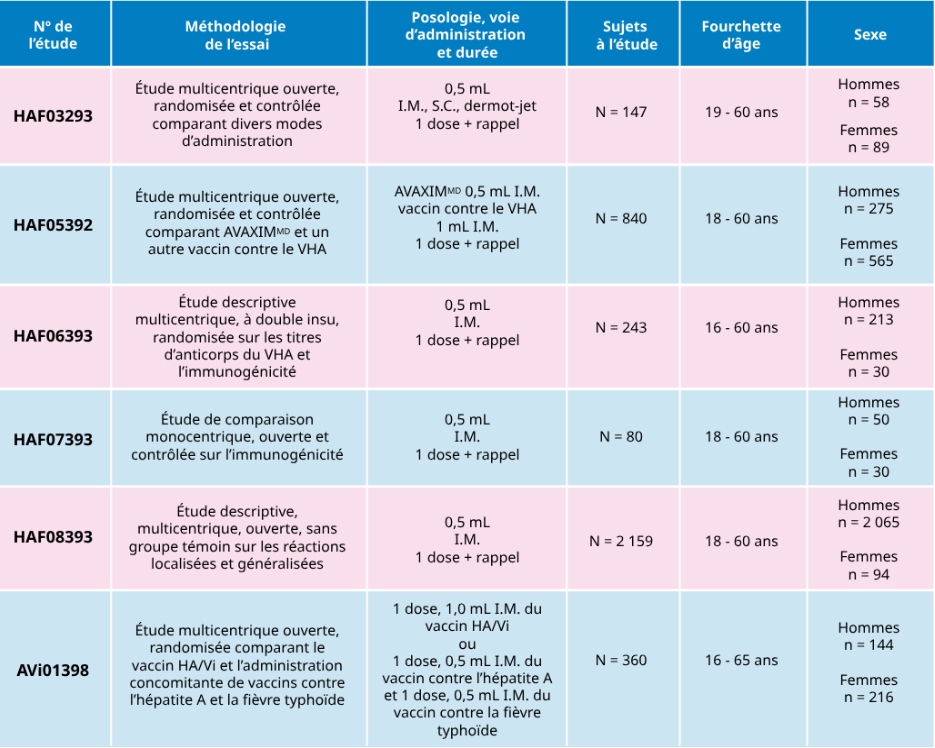
Données sur l’immunogénicit
L’immunité est apparue peu de temps après la première injection et a persisté pendant au moins 36 mois dans le cadre d’études cliniques menées auprès de plus de 1 000 volontaire
AVAXIMMD a conféré l’immunité contre le VHA en induisant des titres d’anticorps supérieurs à ceux obtenus après immunisation passive par immunoglobuline.
Les études ont montré que :
- Des anticorps humoraux spécifiques contre le VHA sont apparus après la première injection.
- Quatorze jours après la vaccination, > 90 % des sujets immunocompétents étaient protégés (titres > 20 mUI/mL).
- Un mois après la première injection, 100 % des sujets étaient protégés.
- L’immunité a persisté pendant au moins 36 mois et a été renforcée après une dose de rappel.
Lors d’essais de comparaison avec un autre vaccin contre l’hépatite A :
- AVAXIMMD a démontré un profil d’immunogénicité supérieur.
- Les taux de séroconversion à 14 jours ont montré que les réponses immunitaires se produisent plus rapidement avec AVAXIMMD. (Cette rapidité de la réponse immunitaire peut constituer un facteur important à prendre en compte lorsque des voyageurs doivent être vaccinés juste avant leur départ ou lorsque la prophylaxie post-exposition ne peut être effectuée juste après l’exposition.
Posologie et administration

Primovaccination
AVAXIMMD doit être administré en une seule injection d’une dose (0,5 mL) par voie intramusculaire.

Deuxième dose
Pour obtenir une protection à long terme, une dose de rappel doit être administrée 6 à 36 mois plus tard.
Étapes pour l’injection
- Avant l’utilisation, examiner le vaccin pour y déceler la présence éventuelle de particules étrangères ou d’une coloration anormale. Si c’est le cas, ne pas administrer le produit.
- Bien agiter la seringue préremplie jusqu’à obtenir une suspension uniforme et trouble.
- AVAXIMMD se présente sous deux formes :
- Si une seringue n’a pas d’aiguille fixée, retirer le capuchon de la seringue, sortir l’aiguille de l’emballage-coque et la fixer à l’extrémité de la seringue préremplie.
- Avec la présentation sous forme de seringue munie d’une aiguille, le vaccin est prêt à l’emploi.
- Une technique aseptique s’impose. Utiliser une aiguille et une seringue stérile distinctes, ou une aiguille montée stérile à usage unique pour chaque patient afin d’éviter toute transmission de maladie. Ne pas remettre les capuchons sur les aiguilles, et se débarrasser de celles-ci conformément aux lignes directrices relatives aux déchets biologiques dangereux.
- Administrer le vaccin par voie intramusculaire, de préférence dans le deltoïde. Ne pas administrer le vaccin dans une fesse.
- Remettre au patient un carnet de vaccination personnel permanent et inscrire les antécédents d’immunisation dans le dossier médical permanent de chaque patient. Cela doit contenir le nom du vaccin, la date d’inoculation, la dose, le nom du fabricant et le numéro de lot.
Profil d’innocuit
Dans 6 essais cliniques qui ont impliqué plus de 2 200 participants, les effets indésirables étaient généralement bénins; par ailleurs, ils étaient limités aux quelques jours suivant la vaccination et se résorbaient d’eux-mêmes.
- Dans de rares cas, on a signalé une légère augmentation passagère des transaminases sériques.
- Dans de très rares cas, on a signalé l’apparition d’un nodule au point d’injection.
- Les effets indésirables étaient moins fréquents après l’administration de la dose de rappel qu’après la première dose.
- AVAXIMMD était généralement aussi bien toléré par les sujets séropositifs au VHA que par les sujets séronégatifs.
- Les enfants hémophiles ont présenté des réactions identiques à celles observées chez les adultes.
- Dans les essais de comparaison menés avec un autre vaccin contre l’hépatite A auprès de 423 adultes au total, les réactions locales étaient nettement moins fréquentes après chaque injection chez les sujets ayant reçu AVAXIMMD.
Fréquence (%) des réactions observées après une dose d’AVAXIMMD
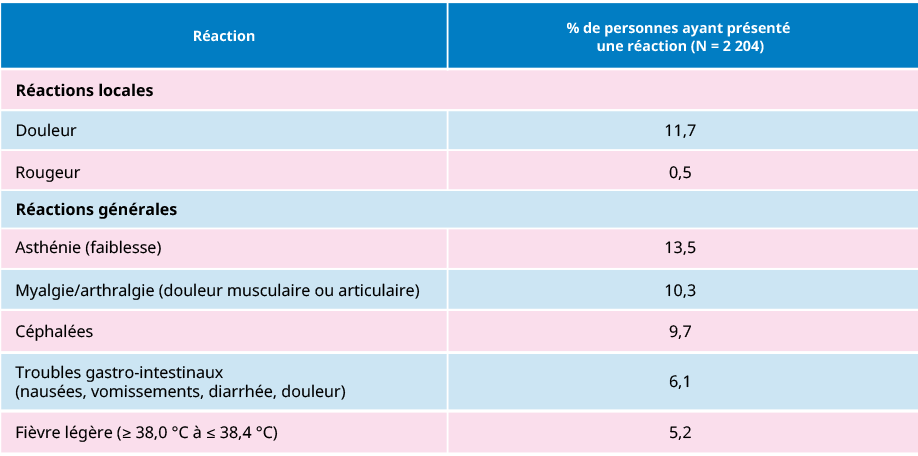%20des%20r%C3%A9actions%20observ%C3%A9es%20apr%C3%A8s%20une%20dose%20d%E2%80%99Avaxim.png)
Ressources
Renseignements relatifs à l’innocuité
CONTRE-INDICATIONS :
AVAXIMMD est contre-indiqué chez les patients qui ont présenté une réaction d’hypersensibilité à ce vaccin lors d’une précédente administration ou à l’un des ingrédients de la préparation, y compris les ingrédients non médicinaux, ou à l’un des composants du contenant.
MISES EN GARDE ET PRÉCAUTIONS PERTINENTES :
- Ne pas administrer par injection intravasculaire ou par voie intradermique. S’assurer que l’aiguille ne pénètre pas dans un vaisseau sanguin. Ne pas administrer dans une fesse.
- Comme avec tout vaccin, il est possible qu’AVAXIMMD ne protège pas 100 % des sujets vaccinés.
- Risque de syncope.
- On ne sait pas si AVAXIMMD permettra de prévenir l’hépatite A si une infection est présente, mais non cliniquement apparente, au moment de la vaccination.
- Hypersensibilité au formaldéhyde et à la néomycine (et à d’autres antibiotiques de la même classe).
Personnes atteintes d’une maladie hépatique. - La vaccination doit être remise à plus tard dans les cas de maladies aiguës ou fébriles.
- AVAXIMMD ne doit pas être administré aux personnes présentant un trouble hémorragique tel que l’hémophilie ou la thrombocytopénie, ou aux personnes qui prennent un anticoagulant, sauf si les avantages escomptés de la vaccination l’emportent sur le risque encouru. Si l’on décide d’administrer un quelconque produit par injection intramusculaire à de tels patients, on procédera avec précaution en prenant des mesures pour éviter le risque de formation d’un hématome après l’injection.
- Dans des cas exceptionnels (par exemple, sujets atteints de thrombopénie ou chez qui il existe un risque d’hémorragie), le vaccin peut être injecté par voie sous-cutanée; toutefois, le risque de réactions locales, notamment de nodule au point d’injection, est alors plus élevé.
- Des réactions d’hypersensibilité peuvent se produire après l'utilisation d’AVAXIMMD, même chez les personnes qui ne comptent pas d’antécédent d’hypersensibilité aux composants de ce produit.
- Il se peut que les personnes immunodéprimées n’obtiennent pas la réponse immunitaire attendue.
- AVAXIMMD ne confère pas de protection contre l’infection causée par le virus de l’hépatite B, le virus de l’hépatite C, le virus delta, le virus de l’hépatite E ou d’autres pathogènes hépatiques distincts du VHA.
- À administrer uniquement à une femme enceinte que si cela est manifestement nécessaire et seulement après l’évaluation des risques et des bienfaits.
- À administrer avec prudence à une femme qui allaite.
- Gériatrie : Santé Canada dispose de peu de données
POUR OBTENIR DE PLUS AMPLES RENSEIGNEMENTS :
Veuillez consulter la Monographie de produit pour obtenir des renseignements importants qui n’ont pas été discutés dans ce document en ce qui concerne toutes les mises en garde et précautions, les effets indésirables, les interactions médicamenteuses et la posologie. Il est aussi possible d’obtenir la Monographie du Produit auprès de notre service médical. Appelez-nous au 1 888 621-1146.
I.M. = intramusculaire; S.C. = sous-cutané.
* La signification clinique est inconnue.
- Monographie de produit : AVAXIMMD. Sanofi Pasteur Limitée. 14 mai 2025.
MAT-CA-2500526-v1.0-05/2025



.jpg/jcr:content/image%20(2).jpg)
.jpg/jcr:content/image%20(3).jpg)
.jpg/jcr:content/image%20(1).jpg)