La saison du VRS est arrivée. BeyfortusMD est à votre disposition¹-³.
BeyfortusMD est un anticorps indiqué pour la prévention de la maladie des voies respiratoires inférieures à VRS chez les nourrissons au cours de leur première saison1†
BeyfortusMD (nirsévimab injectable) est indiqué pour la prévention des maladies des voies respiratoires inférieures causées par le virus respiratoire syncytial (VRS) :
- Les nouveau-nés et les nourrissons pendant leur première saison de VRS.
- Les enfants âgés de moins de 24 mois qui restent vulnérables à une maladie grave due au VRS jusqu’à leur deuxième saison, ce qui peut inclure, sans s’y limiter, les enfants souffrant d’une maladie pulmonaire chronique de la prématurité, d’une cardiopathie congénitale hémodynamique, d’un état d’immunodépression, du syndrome de Down, de mucoviscidose, d’une maladie neuromusculaire et d’anomalies congénitales des voies respiratoires.
Résultats de l’étude
BeyfortusMD a démontré une efficacité statistiquement significative en réduisant le risque relatif d’IVRI à VRS avec AM, y compris les hospitalisations, par rapport au placebo‡§
Étude 3 : Nourrissons très et modérément prématurés¶
entamant leur première saison de VRS (AG ≥ 29 à < 35 semaines)
MELODY : Nourrissons prématurés et prématurés tardifsˡˡ
entamant leur première saison de VRS (AG ≥ 35 semaines)
CRITÈRE D’ÉVALUATION SECONDAIRE (tous les sujets)
Incidence de l’IVRI à VRS avec AM nécessitant une hospitalisation jusqu’à 150 jours après l’injection1
MELODY a continué à recruter des nourrissons après l’analyse primaire et, dans l’ensemble, 3 012 nourrissons (tous les sujets) ont été randomisés pour recevoir BeyfortusMD (n = 2 009) ou un placebo (n = 1 003)1
- RRR de 76,8 % dans l’incidence d’IVRI à VRS avec AM nécessitant une hospitalisation jusqu’au jour 150 par rapport au placebo (IC à 95 % : 49,4; 89,4). L’incidence était de 0,4 % avec BeyfortusMD par rapport à 2,0 % avec le placebo1
Beyfortusᴹᴰ était généralement bien toléré dans les essais cliniques¹
L’effet indésirable le plus fréquent était une éruption cutanée (0,7 % pour BeyfortusMD et 0,3 % pour le placebo, survenant dans les 14 jours suivant l’administration), ainsi qu’une pyrexie (0,5 % contre 0,6 % pour le placebo) et des réactions au site d’injection (0,3 % contre 0 % pour le placebo) dans les 7 jours suivant l’administration.
Le profil d’innocuité de BeyfortusMD était généralement comparable à celui du placebo pour les nourrissons à terme et prématurés (GA ≥ 29 semaines) (données regroupées de l’étude 3 et de MELODY).
Les taux globaux d’événements indésirables (EI), indépendamment de la causalité, étaient de 84,0 % et 82,6 % pour le groupe BeyfortusMD et le groupe placebo, respectivement.
- La majorité des EI étaient de sévérité légère ou modérée.
EI les plus fréquemment rapportés (> 10 % des sujets dans l’un ou l’autre groupe de traitement) pour le groupe BeyfortusMD et le groupe placebo étaient :
- Infection des voies respiratoires supérieures (31,8 % vs 29,9 %);
- Nasopharyngite (19,0 % vs 21,0 %);
- Pyrexie (11,8 % vs 10,3 %)
Les taux d’événements indésirables graves (EIG), indépendamment de la causalité, étaient comparables entre BeyfortusMD et le placebo (7,6 % et 10,5 %).
- Aucun EIG n’a été déterminé comme étant lié à BeyfortusMD.
EIG les plus fréquemment rapportés (≥ 0,5 % des sujets dans l’un ou l’autre groupe de traitement) pour le groupe BeyfortusMD et le groupe placebo, étaient :
- Bronchiolite (1,3 % vs 2,6 %);
- Pneumonie (0,7 % vs 0,9 %);
- Gastroentérite (0,6 % vs 0,4 %);
- IVRI (0,6 % vs 0,8 %);
- Bronchite (0,5 % vs 1,0 %);
- Infection urinaire (0,3 % vs 0,5 %);
- Bronchiolite à VRS (0,2 % vs 0,9 %);
- Hernie inguinale (< 0,1 % vs 0,5 %)
Dans l’étude portant sur 918 nourrissons présentant un risque élevé de maladie grave due au VRS et entrant dans leur première saison de VRS, le profil de sécurité de BeyfortusMD (n = 614) était similaire à celui du palivizumab (n = 304) et conforme à celui observé dans les études portant sur des nourrissons nés à terme et prématurés en bonne santé ≥ 29 semaines d’AG (étude 3 et MELODY)#**.
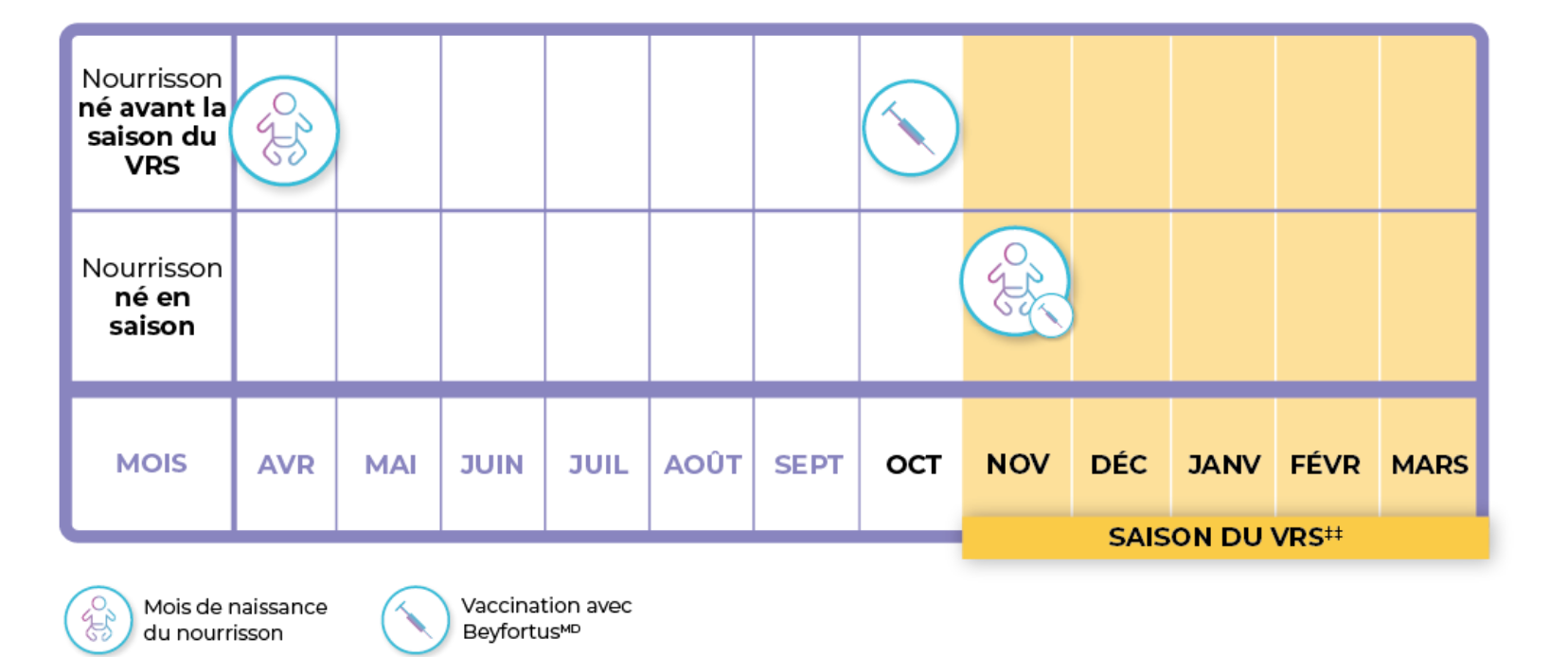
Beyfortusᴹᴰ doit être administré avant le début de la saison du VRS, ou dès la naissance pour les nourrissons nés pendant la saison du VRS¹
Exemple illustratif uniquement††
Renseignements relatifs à l’innocuité
Usage clinique
L’innocuité et l’efficacité n’ont pas été établies chez les enfants de plus de 24 mois. La sécurité et l’efficacité chez les nourrissons dont le poids corporel est inférieur à 1,6 kg n’ont pas été établies. Le dosage chez les nourrissons dont le poids corporel est compris entre 1,0 kg et < 1,6 kg est basé sur une extrapolation. L’efficacité chez les nourrissons qui restent vulnérables à une maladie sévère due au VRS au cours de leur première ou deuxième saison de VRS n’a pas été directement établie et repose uniquement sur une extrapolation de l’exposition.
On dispose de peu d’informations sur les grands prématurés (âge gestationnel [AG] < 29 semaines) âgés de moins de 8 semaines, et aucune donnée clinique n’est disponible sur les nourrissons dont l’âge post-menstruel (âge gestationnel à la naissance plus âge chronologique) est de 32 semaines. Des données limitées sont disponibles chez les nourrissons atteints du syndrome de Down (n = 13), de mucoviscidose (n = 5), d’anomalies congénitales des voies respiratoires (n = 9) et de maladies neuromusculaires (n = 0; non évalué dans les essais cliniques).
Non indiqué dans la population gériatrique (≥ 65 ans).
Mises en garde et précautions pertinentes
- Doit être administré avec prudence aux personnes souffrant de thrombocytopénie, d’un trouble de la coagulation ou d’un traitement anticoagulant.
- Des réactions d'hypersensibilité graves ont été rapportées après l'administration de BEYFORTUSMD. De l’anaphylaxie a été observée avec des anticorps monoclonaux humains de type immunoglobuline G1 (IgG1). En cas de signes et de symptoms d'anaphylaxie ou d'une autre réaction d'hypersensibilité cliniquement significative, cesser immédiatement l'administration et commencer la prise de médicaments appropriés et/ou un traitement de soutien.
- Chez certaines personnes atteintes d’affections avec perte protéique, une augmentation de la clairance du nirsevimab a été observée lors d'essais cliniques. Le nirsevimab pourrait ne pas offrir le même niveau de protection chez les personnes présentant une perte protéique importante.
- Femmes enceintes et qui allaitent : non indiqué pour les adultes.
Pour de plus amples renseignements
Veuillez consulter la monographie de produit pour obtenir des renseignements importants sur les effets indésirables et les interactions médicamenteuses et la posologie. La monographie de produit peut aussi être obtenue en téléphonant au 1 800 265-7927.
IC = intervalle de confiance; AG = âge gestationnel; IVRI = infection des voies respiratoires inférieures, AM = assistance médicale; RRR = réduction du risque relatif; VRS = virus respiratoire syncytial; RT-PCR = réaction en chaîne de la polymérase par transcription inverse.
* La signification clinique est inconnue.
† BeyfortusMD est un anticorps monoclonal humain1.
‡ Les signes d’IVRI étaient définis par la présence, lors de l’examen physique, de l’une des constatations suivantes indiquant une atteinte des voies respiratoires inférieures (par exemple, rhonchi, râles, crépitants ou sifflements); et d’au moins un signe de sévérité clinique (augmentation de la fréquence respiratoire, hypoxémie, insuffisance hypoxique ou ventilatoire aiguë, apnée d’apparition récente, évasement nasal, rétractions, grognements ou déshydratation due à la détresse respiratoire). L’hospitalisation pour VRS a été définie comme une hospitalisation pour une IVRI avec un test VRS positif, ou une aggravation de l’état respiratoire et un test VRS positif chez un patient déjà hospitalisé.
§ La réduction du risque relatif et l’IC à 95 % ont été calculés à l’aide d’une régression de Poisson modifiée avec une variance robuste incluant des facteurs de stratification (hémisphère et âge au moment de la randomisation).
¶ Plan de l’étude : Essai multicentrique de phase 2b, à répartition aléatoire, à double insu, contrôlé par placebo. La population étudiée comprenait 1 453 nourrissons très et modérément prématurés (AG ≥ 29 à < 35 semaines) entrant dans leur première saison de VRS. Les nourrissons ont été répartis aléatoirement selon un rapport de 2:1 pour recevoir une dose unique fixe de 50 mg de BeyfortusMD (n = 969) ou un placebo (n = 484). Remarque : 50 mg n’est pas une dose recommandée pour les nourrissons dont le poids corporel est ≥ 5 kg. La dose recommandée pour les nourrissons dont le poids corporel est ≥ 5 kg est une dose IM unique de 100 mg.
|| Plan de l’étude : Essai clinique multicentrique de phase 3, à répartition aléatoire, à double insu, contrôlé par placebo. La population étudiée comprenait 1 490 nourrissons à terme et grands prématurés (AG ≥ 35 semaines) entrant dans leur première saison de VRS pour la cohorte primaire, et 3 012 nourrissons à terme et grands prématurés (AG ≥ 35 semaines) entrant dans leur première saison de VRS pour l’ensemble des sujets. Les nourrissons ont été répartis aléatoirement selon un rapport de 2:1 pour recevoir une dose intramusculaire unique de 50 mg de BeyfortusMD si le poids est < 5 kg ou de 100 mg de BeyfortusMD si le poids est ≥ 5 kg au moment de l’administration (n = 994), ou un placebo (n = 496) pour la cohorte primaire, BeyfortusMD (n = 2 009), ou un placebo (n = 1 003) pour tous les sujets1.
# Les nourrissons présentant un risque plus élevé de maladie grave due au VRS comprenaient 196 grands prématurés (AG < 29 semaines) et 306 nourrissons atteints d’une maladie pulmonaire chronique de la prématurité et d’une cardiopathie congénitale hémodynamiquement significative, nés à terme ou prématurés1.
** Les données disponibles chez les grands prématurés (AG < 29 semaines) âgés de moins de 8 semaines sont limitées. Aucune donnée clinique n’est disponible chez les nourrissons dont l’âge post-menstruel (AG à la naissance plus âge chronologique) est de 32 semaines. Des données limitées sont disponibles chez les nourrissons atteints du syndrome de Down (n = 13), de mucoviscidose (n = 5), d’anomalies congénitales des voies respiratoires (n = 9) et de maladies neuromusculaires (n = 0; non évalué dans les essais cliniques)1.
†† Le tableau ne représente que des exemples et n’est pas obligatoire/recommandé.
‡‡ La zone ombrée indique une saison typique du VRS dans un climat tempéré de l’hémisphère nord. La saison du VRS varie selon la région5.
- Monographie de BeyfortusMD, Sanofi Pasteur Limitée, 29 mai 2023.
- Bianchini S, et al. Microorganisms 2020;8:2048. doi: 10.3390/microorganisms8122048.
- Pisesky A, et al. PLoS One 2016;11(3):e0150416. doi: 10.1371/journal.pone.0150416.
- Griffin MP et al. N Engl J Med 2020;383:415–25. doi: 10.1056/NEJMoa1913556.
- Obando-Pacheco P, et al. J Infect Dis 2018;217:1356–64.
© 2025 Sanofi Pasteur Limitée. Tous droits réservés.
MAT-CA-2500072E-v1.0-03/2025







-FR.jpg)
-Bilingual.jpg)
-FR.jpg)

.jpg/jcr:content/image%20(2).jpg)
.jpg/jcr:content/image%20(3).jpg)
.jpg/jcr:content/image%20(1).jpg)