- Articolo
- Fonte: Campus Sanofi
- 15 feb 2024
L’infiammazione di tipo 2 nell’Esofagite Eosinofila
Introduzione
L’esofagite eosinofila (EoE) è una patologia immuno-infiammatoria cronica e progressiva che si caratterizza per la presenza di sintomi da disfunzione esofagea associati ad una spiccata infiammazione di tipo 2 attiva nel contesto della mucosa, e mediata prevalentemente da granulociti eosinofili1.
Gli attori dell’infiammazione di tipo 2
L’infiammazione è alimentata dall’attività di diverse cellule e mediatori infiammatori, tra cui eosinofili, mastociti, basofili, linfociti T e B e immunoglobuline che infiltrano la mucosa esofagea, dove vengono rilasciate citochine dell’infiammazione di tipo 2, come interleuchina IL-4, IL-5 e IL-13 2.
.png)
Eosinofili
Assenti nel tessuto esofageo sano, presenti nei pazienti affetti da EoE
.png)
Mastociti
Presenti nel tessuto esofageo sano. Aumento significativo nei pazienti con EoE
.png)
Basofili
Implicati nell'infiammazione allergica e presenti in numero maggiore nei pazienti affetti da EoE

ILC2
Partecipano alla produzione di citochine di tipo 2:IL-4, IL-5 e IL-13
.png)
Cellule dendritiche
Implicate nelle malattie infiammatorie di tipo 2
.png)
Linfociti B
Precursori delle IgE e altamente presenti in pazienti con EoE. L'esspressione di EoE può comunque essere indipendente dalla presenza di queste cellule
.png)
Linfociti T
Giocano un ruola centrale nell'EoE e in una maggiore espressione di linfociti T CD4+ e CD8+
.png)
Eosinofili
Assenti nel tessuto esofageo sano, presenti nei pazienti affetti da EoE
.png)
Mastociti
Presenti nel tessuto esofageo sano. Aumento significativo nei pazienti con EoE
.png)
Basofili
Implicati nell'infiammazione allergica e presenti in numero maggiore nei pazienti affetti da EoE

ILC2
Partecipano alla produzione di citochine di tipo 2:IL-4, IL-5 e IL-13
.png)
Cellule dendritiche
Implicate nelle malattie infiammatorie di tipo 2
.png)
Linfociti B
Precursori delle IgE e altamente presenti in pazienti con EoE. L'esspressione di EoE può comunque essere indipendente dalla presenza di queste cellule
.png)
Linfociti T
Giocano un ruola centrale nell'EoE e in una maggiore espressione di linfociti T CD4+ e CD8+
Rielaborazione da ref. 2
Meccanismo d’azione e fisiopatologia dell’EoE
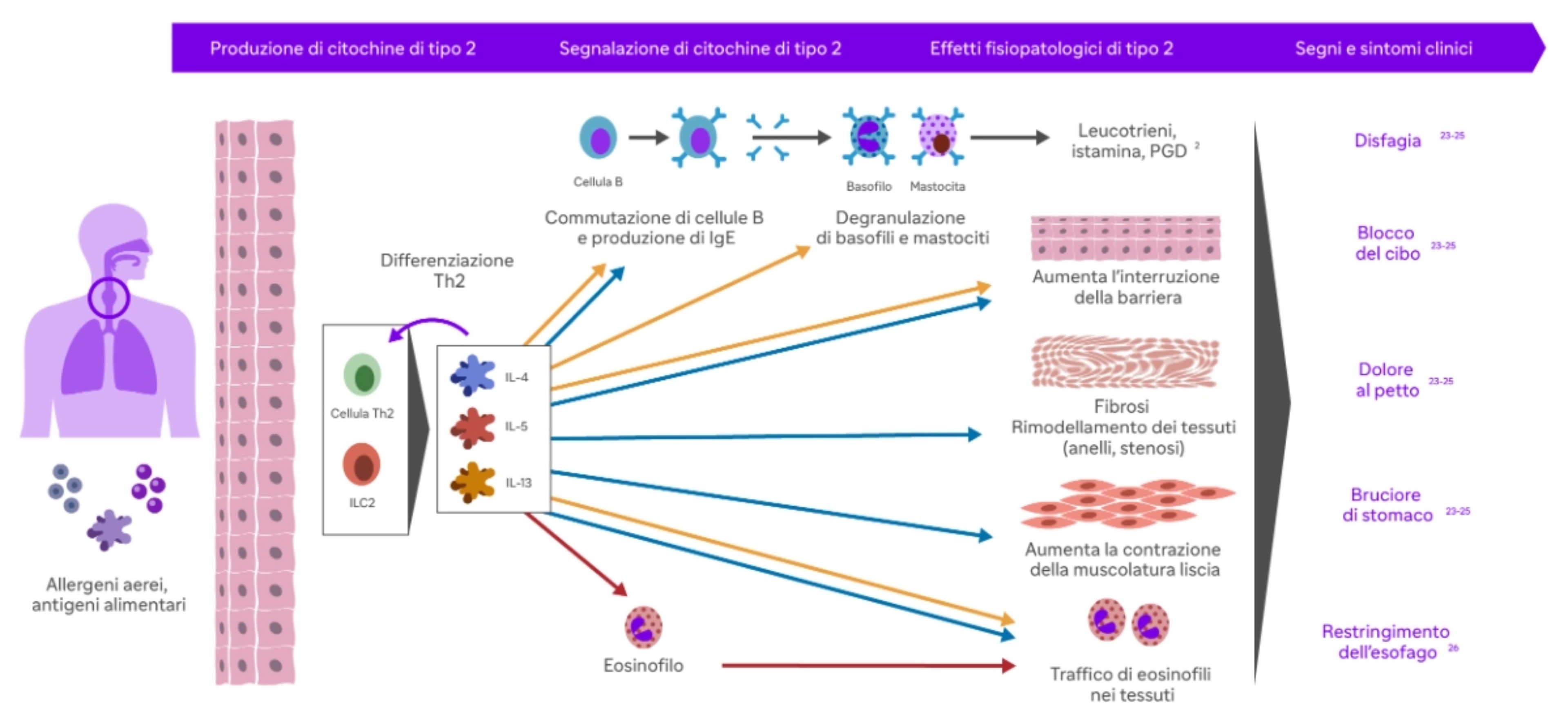
L'infiammazione di tipo 2 inizia con l'attivazione delle cellule T helper di tipo 2 (Th2) del sistema immunitario. Queste cellule riconoscono allergeni o altri stimoli come estranei e iniziano a produrre citochine di tipo 2, come l'interleuchina-4 (IL-4), l’interleuchina 5 (IL-5), e l'interleuchina-13, che promuovono l'infiammazione cronica 2.
Rielaborazione grafica da dati testuali, ref.2, 4, 5, 6, 7, 8
Ruolo delle interleuchine IL-4, IL-5 e IL-13 nell’EoE
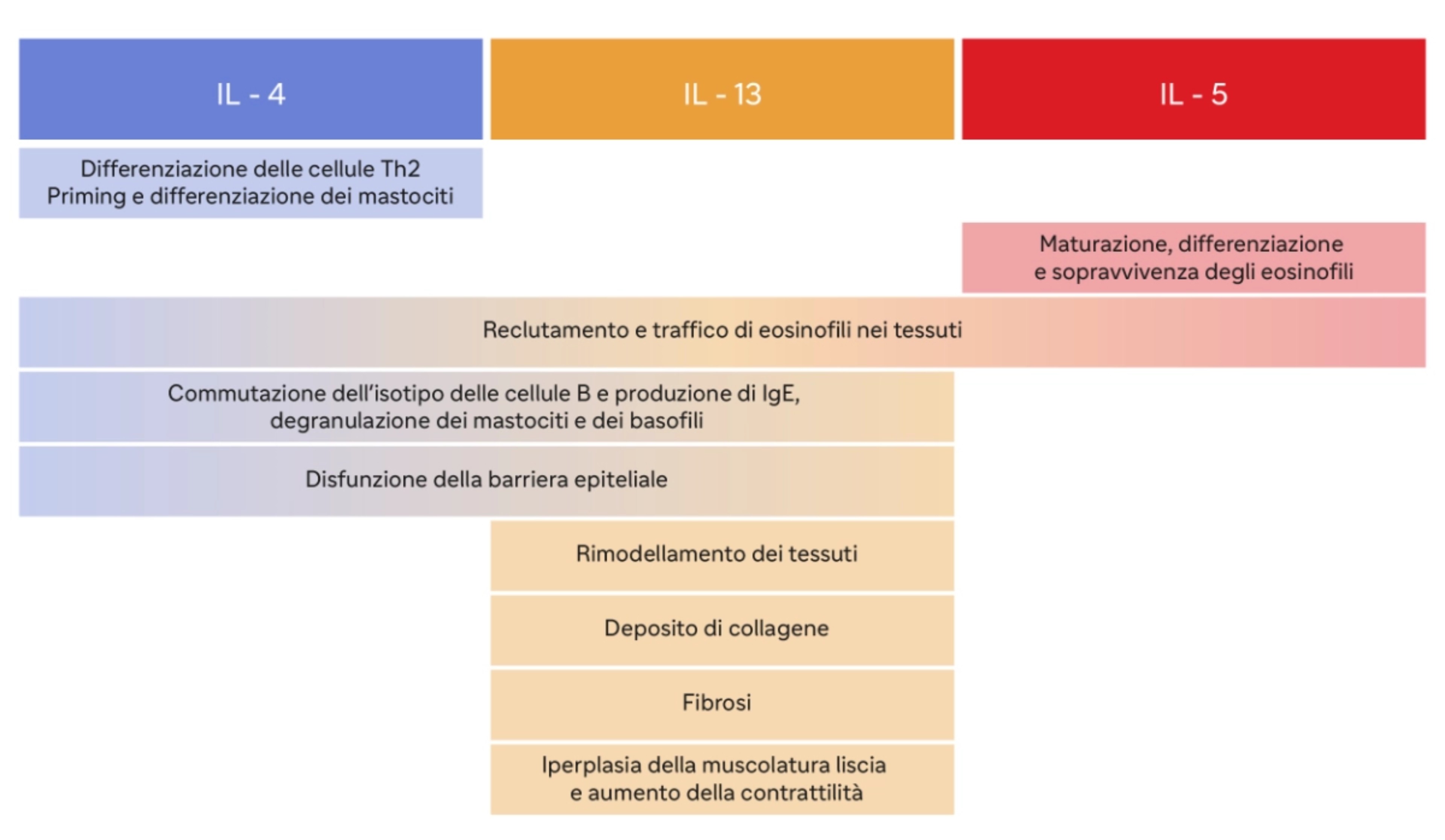
L’IL-4 favorisce lo sviluppo delle cellule T helper di tipo 2 (Th2) e stimola la produzione di anticorpi IgE. Inoltre, promuove la differenziazione delle cellule B in plasmacellule che producono IgE, contribuendo così alla risposta allergica9.
L’IL-5 recluta gli eosinofili a livello esofageo con possibile effetto sui mastociti. Gli eosinofili reclutati, infine, vanno a rilasciare proteine tossiche per l’epitelio e a produrre fattori aggiuntivi, come il fattore di crescita trasformante (TGF) beta, che promuovono il rimodellamento esofageo, contribuendo alle complicanze fibrostenotiche della malattia10.
L’IL-13 induce la secrezione di eotassina-3, una potente chemochina che recluta e attiva gli eosinofili a livello esofageo, e calpain 14, un enzima proteolitico esofago-specifico che distrugge la desmogleina-1, andando a lesionare la barriera epiteliale esofagea, e riduce i livelli di filaggrina a livello dell’epitelio esofageo, aumentando la permeabilità agli allergeni.
L'IL-13 è coinvolta anche nella fibrosi, cioè nella formazione di tessuto cicatriziale, che può verificarsi nei casi di infiammazione cronica10.
Rielaborazione grafica da testo, ref.11, 12, 13,14, 15, 16, 17,18
Cosa succede nell'esofago?
I danni dell’infiammazione di tipo 2
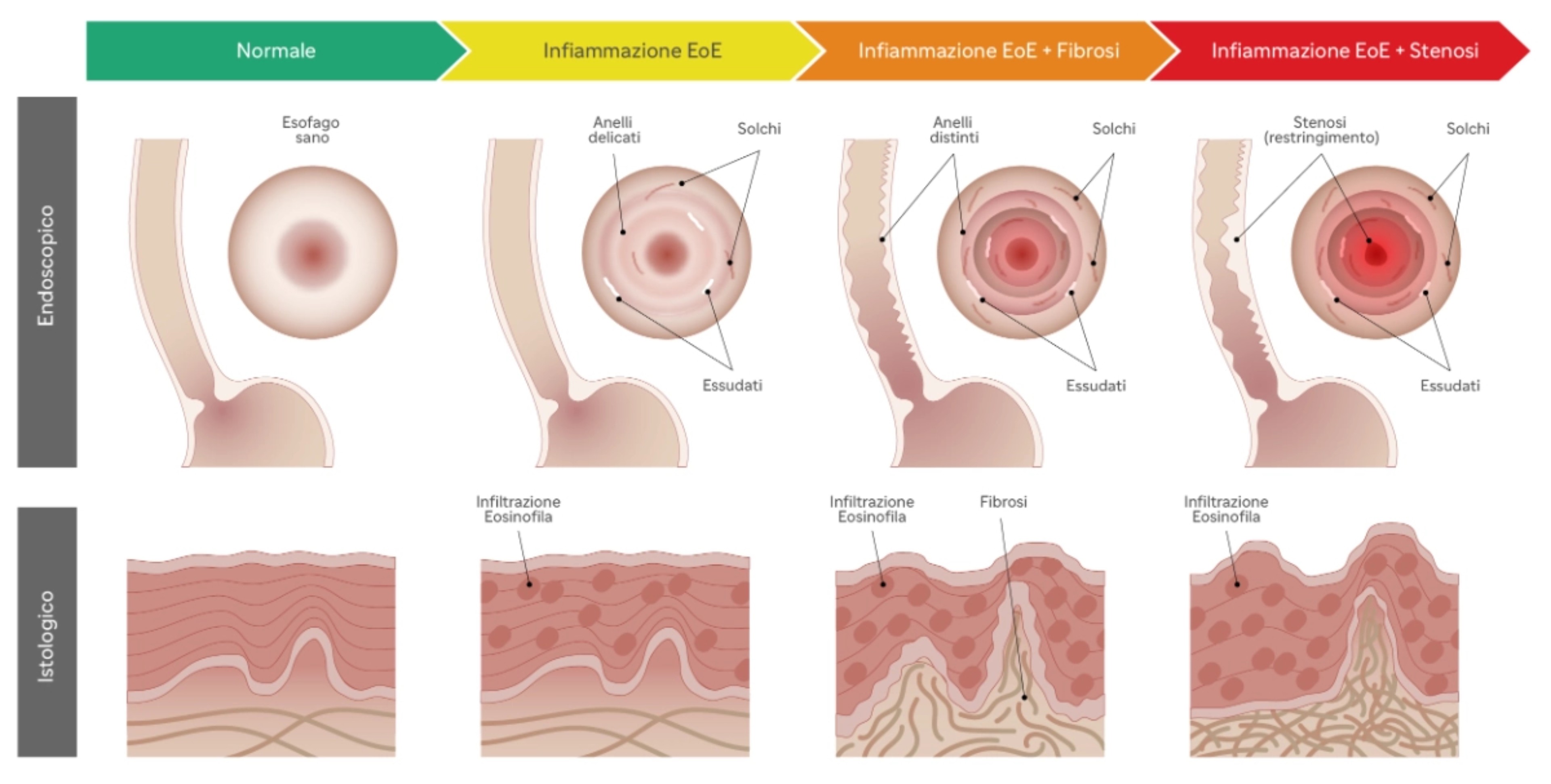
L’ infiammazione eosinofilica cronica induce l’attivazione del processo fibrotico, che è responsabile del graduale e progressivo rimodellamento della parete esofagea4 e della stenosi, una condizione in cui l'esofago si restringe significativamente 19, 20, 21.
Tale processo evolutivo spiega l’andamento clinico dell’EoE, che si presenta con quadri completamente diversi man mano che si passa dalla prima infanzia all’età adulta 3, 19.
Rielaborazione grafica da dati testuali, ref. 3
Infatti, nei bambini più piccoli i sintomi, specchio della infiammazione esofagea e della conseguente dismotilità, sono spesso sovrapponibili a quelli riscontrati nella malattia da reflusso gastroesofageo; negli adolescenti e negli adulti, invece, le manifestazioni cliniche sono espressione dell’evoluzione fibrostenotica della malattia e sono rappresentate prevalentemente da disfagia cronica ed episodi acuti di food impaction (blocco del bolo alimentare nel tratto esofageo), che spesso richiedono l’ospedalizzazione e la rimozione endoscopica del bolo, con dei risvolti psicologici ed economici non sottovalutabili1, 2.
È stato dimostrato che la prevalenza di complicanze fibrostenotiche nei pazienti con EoE aumenta all’aumentare del ritardo diagnostico, e comunque in assenza di terapia e in presenza di infiammazione attiva22.
Lista delle abbreviazioni
EoE = Esofagite Eosinofila
IgE = Immunoglobulina di tipo E
IL = Interleuchina
ILC2 = Cellule Linfoidi innate di tipo 2
LES = Valvola esofagea inferiore
Th2 = T Helper di tipo 2
Bibliografia
- Visaggi P, Savarino E, Sciume G, et al. Eosinophilic esophagitis: clinical, endoscopic, histologic and therapeutic differences and similarities between children and adults. Therap Adv Gastroenterol. 2021;14:1756284820980860
- Muir AB, Wang JX, Nakagawa H. Epithelial-stromal crosstalk and fibrosis in eosinophilic esophagitis. J Gastroenterol. 2019;54(1):10-18. doi:10.1007/s00535-018-1498-3
- Dellon ES, Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):319-332.e3. doi:10.1053/j.gastro.2017.06.067
- Gause WC, et al. Nat Rev Immunol. 2013;13(8):607–614.
- Croese J, et al. Gastrointestinal Endoscopy. 2003;58(4):516–522.
- Kapel RC, et al. Gastroenterology. 2008;134(5):1316–1321.
- Sgouros SN, et al. Eu J Gastroenterol Hepatol. 2006;18(2):211–217.
- Kim HP, et al. Clin Gastroenterol Hepatol. 2012;10(9):988–996.
- Hill DA, Spergel JM. The Immunologic Mechanisms of Eosinophilic Esophagitis. Curr Allergy Asthma Rep. 2016;16(2):9. doi:10.1007/s11882-015-0592-3
- Clayton F, Peterson K. Eosinophilic Esophagitis: Pathophysiology and Definition. Gastrointest Endosc Clin N Am. 2018;28:1-14.
- Davis BP, Rothenberg ME. Mechanisms of Disease of Eosinophilic Esophagitis. Annu Rev Pathol. 2016;11:365-393. doi:10.1146/annurev-pathol-012615-044241
- O'Shea, K. M., Aceves, S. S., Dellon, E. S., Gupta, S. K., Spergel, J. M., Furuta, G. T., & Rothenberg, M. E. (2018). Pathophysiology of Eosinophilic Esophagitis. Gastroenterology, 154(2), 333–345. https://doi.org/10.1053/j.gastro.2017.06.065
- Stone KD, Prussin C, Metcalfe DD. IgE, mast cells, basophils, and eosinophils. J Allergy Clin Immunol. 2010;125(2 Suppl 2):S73-S80. doi:10.1016/j.jaci.2009.11.017
- McLeod JJ, Baker B, Ryan JJ. Mast cell production and response to IL-4 and IL-13. Cytokine. 2015;75(1):57-61. doi:10.1016/j.cyto.2015.05.019
- Roufosse F. Targeting the Interleukin-5 Pathway for Treatment of Eosinophilic Conditions Other than Asthma. Front Med (Lausanne). 2018;5:49. Published 2018 Apr 6. doi:10.3389/fmed.2018.00049
- Munitz A, Brandt EB, Mingler M, Finkelman FD, Rothenberg ME. Distinct roles for IL-13 and IL-4 via IL-13 receptor alpha1 and the type II IL-4 receptor in asthma pathogenesis. Proc Natl Acad Sci U S A. 2008;105(20):7240-7245. doi:10.1073/pnas.0802465105
- Zhu J. T helper 2 (Th2) cell differentiation, type 2 innate lymphoid cell (ILC2) development and regulation of interleukin-4 (IL-4) and IL-13 production. Cytokine. 2015;75(1):14-24. doi:10.1016/j.cyto.2015.05.010
- Le Floc'h A, Allinne J, Nagashima K, et al. Dual blockade of IL-4 and IL-13 with dupilumab, an IL-4Rα antibody, is required to broadly inhibit type 2 inflammation. Allergy. 2020;75(5):1188-1204. doi:10.1111/all.14151
- Lucendo AJ, Molina-Infante J, Arias Á, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335-358. doi:10.1177/2050640616689525
- Dellon ES, Liacouras CA. Advances in clinical management of eosinophilic esophagitis. Gastroenterology. 2014;147(6):1238-1254. doi:10.1053/j.gastro.2014.07.055
- Ahmed M. (2016). Eosinophilic esophagitis in adults: An update. World journal of gastrointestinal pharmacology and therapeutics, 7(2), 207–213. https://doi.org/10.4292/wjgpt.v7.i2.207
- Dellon ES, Kim HP, Sperry SL, et al. A phenotypic analysis shows that eosinophilic esophagitis is a progressive fibrostenotic disease. Gastrointest Endosc. 2014;79(4):577-85.e4.
MAT-IT-2302891