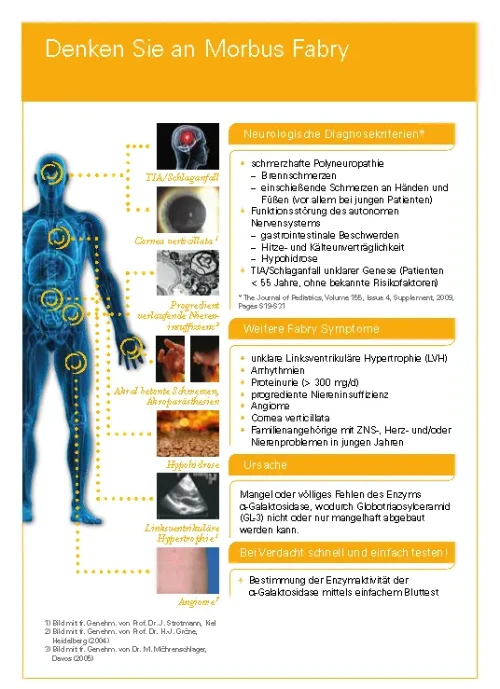
Kälteagglutinin-Krankheit (CAD)
WAS IST DIE KÄLTEAGGLUTININ-KRANKHEIT (CAD)?
Die Kälteagglutinin-Krankheit (engl.: cold agglutinin disease; CAD) oder auch autoimmunhämolytische Anämie vom Kälteantikörpertyp (cAIHA) ist eine seltene, erworbene Bluterkrankung. Sie wird durch sogenannte Kälteantikörper verursacht, die unterhalb der Körperkerntemperatur (≤ 37 °C mit einem Optimum von 3 bis 4 °C) an Oberflächenantigene von Erythrozyten binden (I-, seltener i-Antigen). Die Kälteantikörper verursachen klinische Symptome, die zum einen mit der Agglutination der Erythrozyten in kühleren Körperregionen, den Akren, und zum anderen mit einer hämolytischen Anämie zusammenhängen können. Die Bindung der Kälteantikörper an die Erythrozytenoberfläche führt zu einem vorzeitigen Abbau der Erythrozyten (Hämolyse) durch das Komplementsystem und dadurch ggf. zur Anämie1.
Zu den wichtigen Symptomen der Kälteagglutinin-Krankheit (CAD) gehören zudem u. a. Akrozyanose1,2, das Raynaud-Phänomen1,2, Livedo reticularis (Kältemarmorierung)3, Ischämien2, Fatigue1 und/oder Hämoglobinurie4.
Alle Symptome können die Lebensqualität der Patienten beeinträchtigen5. Dabei wird die Krankheitslast meist unterschätzt. Patienten mit Kälteagglutinin-Krankheit (CAD) haben zusätzlich ein signifikant höheres Risiko für Thromboembolien. Zuletzt haben Studien auch eine höhere Sterblichkeitsrate in den ersten fünf Jahren nach Diagnose nachgewiesen5–9.
Prävalenz und Inzidenz
Etwa 15–25 % der erworbenen AIHA gehören zum Kälteantikörpertyp. Davon abzugrenzen sind AIHA vom Wärmeantikörpertyp (wAIHA) und gemischte Formen. Die Kälteagglutinin-Krankheit (CAD) hat eine Prävalenz von 16/1.000.00010–12. In einer dänischen Populationsanalyse lag die Inzidenzrate im Jahr 2013 bei 1,8/1.000.000 Personenjahren6. Das mediane Alter zum Zeitpunkt der Diagnose liegt zwischen dem 60. und 70. Lebensjahr. Frauen sind etwas häufiger von der Erkrankung betroffen als Männer5–9, 13.
Einteilung
Bisher gibt es keine einheitliche Klassifikation der Kälteagglutinin-Krankheit (CAD). Unterschieden wird zwischen der primären Kälteagglutinin-Krankheit (CAD) und dem sekundären Kälteagglutinin-Syndrom (CAS)1. Im Fall von CAD sind keine anderen Erkrankungen feststellbar. Bei einem Nachweis von Kälteagglutininen im Rahmen einer Grunderkrankung, wie z. B. einer Infektion mit Mycoplasmen oder dem Epstein-Barr-Virus, einer anderen Autoimmunerkrankung oder eines malignen Lymphoms, spricht man hingegen von CAS.
Pathophysiologie und Ätiologie der Kälteagglutinin-Krankheit (CAD)
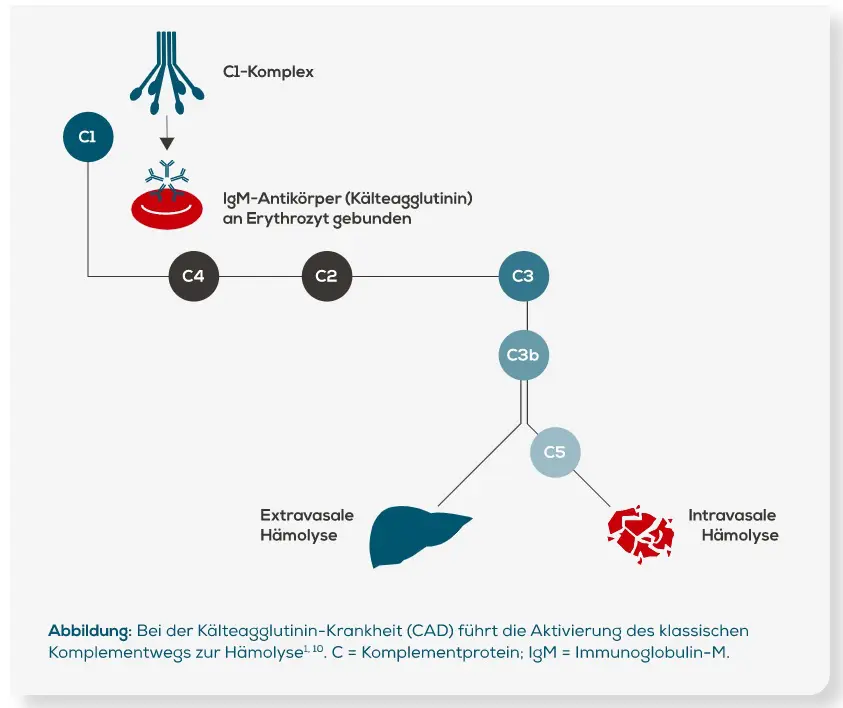
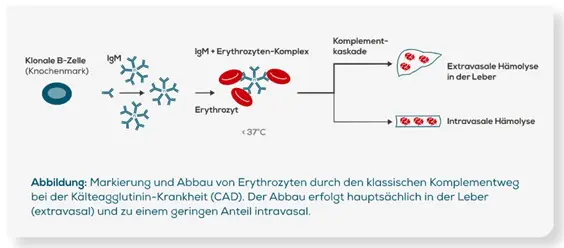
Die Kälteagglutinin-Krankheit (CAD) ist eine chronische Erkrankung, die zu einer Aktivierung des klassischen Komplementsystems führt. Kälteautoantikörper (Kälteagglutinine) sind typischerweise Antikörper des Immunglobulin-M(IgM-)Typs. Sie binden bei Temperaturen ≤ 37 °C an die I-Antigene auf der Oberfläche roter Blutzellen (Erythrozyten), wodurch es zur Agglutination von IgM und Erythrozyten kommt. Dies geschieht in kälteren Körperregionen wie den Akren und vor allem bei kühleren Umgebungstemperaturen in Abhängigkeit von der Thermalamplitude des IgM-Antikörpers1. Abzugrenzen davon sind die Kryoglobuline. Hierbei handelt es sich meist um Antikörper der Klasse IgM, die bei Temperaturen unter 37 °C aneinanderbinden, ausfallen und sich bei Erwärmung wieder auflösen14.
Die gebundenen Kälteantikörper aktivieren über den C1-Komplex die Komplementkaskade des klassischen Komplementweges (im Gegensatz zum Lektinweg und dem alternativen Komplementweg, die ebenfalls Teil des Komplementsystems sind)1,4. Die C1-Esterase aktiviert C4 und C2, was zur Produktion der C3-Konvertase führt, die C3 in C3a und C3b spaltet, wie in der Abbildung dargestellt. Im Verlauf kommt es so zur Ablagerung des C3b-Komplementfaktors auf den Erythrozyten, welche nun für eine extravasale Phagozytose in der Leber markiert sind. Durch die Aktivierung der terminalen Komplementkaskade über den Komplementfaktor C5 kann es auch in geringem Maße zu einer intravasalen Hämolyse kommen1,15.
Die Aggregation der IgM-Kälteautoantikörper mit den Erythrozyten ist reversibel. Darum ist es möglich, dass kälteinduzierte Krankheitssymptome nur vorübergehend auftreten und bei wärmeren Temperaturen wieder verschwinden. Die betroffenen Erythrozyten werden aber weiter abgebaut. Daher sind hämolytische Symptome der Kälteagglutinin-Krankheit (CAD) oft chronisch und nicht reversibel1.
Die Symptome oder Beschwerden der Patienten mit Kälteagglutinin-Krankheit (CAD) können unterschiedlich ausgeprägt sein. Angesichts der Fähigkeit des Körpers, die Erythrozytenproduktion auf das Achtfache zu steigern, weisen einige Patienten eine vollständig kompensierte Hämolyse oder nur eine milde Anämie ohne Symptome auf. Bei anderen Patienten können Symptome wie z. B. eine ausgeprägte Fatigue, Dyspnoe, Herzklopfen, Blässe und/oder Ikterus vorliegen. Durch kalte Temperaturen, aber auch Infektionen, Operationen oder andere Auslöser kann es selbst bei Patienten mit einer milden Symptomatik zur Exazerbation der Anämie beziehungsweise einer krisenhaften Hämolyse kommen1,5,18.
Die größte veröffentlichte Fallserie, bei der Daten von 232 Patienten mit Kälteagglutinin-Krankheit (CAD) ausgewertet wurden, ergab die folgenden Häufigkeiten für Befunde19:
- 90 % Anämie (medianes Hämoglobin: 9,5 g/dL; bei 10 % kompensierter Hämolyse)
- 90 % Hämolysezeichen (hohe Werte für Bilirubin und Laktatdehydrogenase [LDH]; erniedrigtes Haptoglobin)
- 52 % kälteinduzierte Symptome (meist Akrozyanose)
Schwerere kälteinduzierte Symptome wie das Raynaud-Phänomen oder sogar Ulzerationen traten nur zu einem kleinen Anteil auf. In 38 – 47 % dieser Fälle erhielten die Patienten Transfusionen entweder vor der Erstdiagnose oder während der Verlaufskontrollen19.
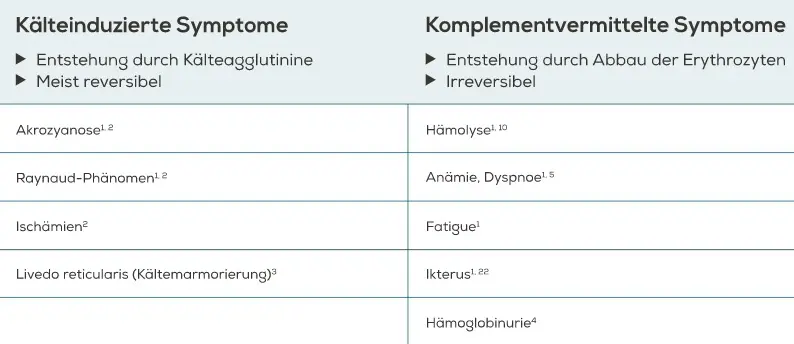
Bei Patienten mit Kälteagglutinin-Krankheit (CAD) unterscheidet man zwischen kälteinduzierten reversiblen Symptomen und chronischen komplementvermittelten Symptomen (vgl. Abschnitt Pathophysiologie und Ätiologie). Kälteinduzierte Symptome, die aufgrund der agglutinierten Erythrozyten entstehen, treten häufig auf. Sie sind vorübergehend und verschwinden bei warmen Temperaturen wieder, können aber dennoch als sehr unangenehm empfunden werden1. Weiterhin besteht aufgrund der Kälteagglutinin-Krankheit (CAD) ein erhöhtes Risiko für Thromboembolien20,21 (vgl. Abschnitt Krankheitslast).
Kälteinduzierte Symptome Kälteinduzierte Symptome entstehen bei der Kälteagglutinin-Krankheit (CAD) aufgrund der Agglutination der Erythrozyten durch IgM bei Temperaturen unterhalb der Körperkerntemperatur (vgl. Abschnitt Pathophysiologie und Ätiologie). Die Symptome treten vor allem im Bereich der Akren auf und sind bei der Kälteagglutinin-Krankheit (CAD) sehr typisch und häufig. Sie sind leicht bis schwer ausgeprägt und verschwinden bei Erwärmung wieder1.
Wichtige kälteinduzierte Symptome sind Akrozyanose – eine dunkelviolette bis graue Verfärbung der Haut in den Akralbereichen (z. B. Fingerspitzen, Zehen, Nase und Ohren) und Livedo reticularis/Kältemarmorierung – eine brüchige, fleckige Haut mit vernetzten Gefäßmustern und einer rot-blauen Färbung. Außerdem kommen scharf abgegrenzte Farbveränderungen der Haut an den Fingern (Raynaud-Phänomen), Hautulzeration oder in schweren Fällen sogar Nekrosen (Gangrän) vor2,3,23. Patienten berichten darüber hinaus von Unbehagen bis hin zu Schmerzen beim Schlucken von kalten Speisen oder Flüssigkeiten11.
Ein wichtiges Kriterium für die Klassifizierung der Kälteagglutinin-Krankheit (CAD) als autoimmunhämolytische Anämie (AIHA) ist der Nachweis der Hämolyse1. Patienten mit Kälteagglutinin-Krankheit (CAD) zeigen oft chronische Hämolysezeichen2, wobei neben erniedrigten Hämoglobin-Werten erhöhte Bilirubin- und/oder Lactatdehydrogenase-(LDH-) und erniedrigte Haptoglobin-Werte auftreten können (vgl. Abschnitt Diagnose)1.
Symptome einer Anämie sind bei Patienten mit Kälteagglutinin-Krankheit (CAD) sehr variabel. Es können Belastungsdyspnoe, Dyspnoe in Ruhe und verschiedene Grade von Müdigkeit (Fatigue) auftreten. Die Fatigue ist dabei nicht nur eine Folge der Anämie, sondern auch der Komplementaktivierung und Hämolyse5,10,22. Einige Personen können eine Gelbsucht oder eine leichte Splenomegalie im Zusammenhang mit einer Hämolyse entwickeln1.
Der Schweregrad der Kälteagglutinin-Krankheit (CAD) reicht von einer vollständig kompensierten Hämolyse ohne Anämie bis hin zur schweren hämolytischen Anämie, die Transfusionen erfordert11,19. Einige Patienten leiden an einer chronischen kompensierten hämolytischen Anämie mit Episoden/Krisen von schwerer Anämie, beispielsweise ausgelöst durch kalte Temperaturen, Infekt- oder Entzündungsreaktionen18,24. Die Kälteagglutinin-Krankheit (CAD) wird als schwer bezeichnet, wenn der Hb-Wert auf unter 8 g/dl sinkt und unter Umständen eine Transfusion nötig ist. Häufig treten hierbei auch relevante Symptome einer Anämie auf1.
In größeren Fallserien betragen die medianen Hämoglobinwerte bei der Kälteagglutinin-Krankheit (CAD) 9 bis 10 g/dl. Einige Personen liegen dabei im Normbereich und andere nur bei 4,5 g/dl Hämoglobin12,19. In einer großen Serie von 232 CAD-Patienten wiesen 25 bis 30 % einen Hämoglobinwert von < 8 g/dl auf19. Eine weitere Studie verzeichnete bei 72 % der Patienten mit Kälteagglutinin-Krankheit (CAD) innerhalb des ersten Jahres eine schwere Anämie5.
Alle Symptome der Kälteagglutinin-Krankheit (CAD) können die Lebensqualität der Patienten beeinträchtigen5. Dabei wird die Krankheitslast meist unterschätzt. Patienten mit Kälteagglutinin-Krankheit (CAD) haben, ebenso wie Personen mit anderen hämolytischen Erkrankungen, zusätzlich ein signifikant höheres Risiko für Thromboembolien. Zuletzt wiesen Studien auch eine höhere Sterblichkeitsrate in den ersten fünf Jahren nach Diagnose nach5–9.
Das wichtigste Anzeichen der Kälteagglutinin-Krankheit (CAD) ist die Hämolyse. Diese geht u. a. mit erhöhten Bilirubin-, LDH- und erniedrigten Haptoglobin-Werten einher (vgl. Abschnitt Hämolysezeichen). Außerdem sollten eine Retikulozytose sowie freies Hämoglobin im Serum und Hämosiderin im Urin geprüft werden. Zwar ist bei der intravasalen Hämolyse besonders der LDH-Wert und bei der extravasalen Hämolyse das unkonjugierte Bilirubin erhöht, beide Parameter sind jedoch nicht spezifisch und erhöhte Werte kommen auch bei einer Vielzahl anderer Erkrankungen vor. Daher ist zur Diagnose der Kälteagglutinin-Krankheit (CAD) ein monospezifischer direkter Coombs-Test (direkter Antiglobulintest; DAT) notwendig, der positiv für den Komplementfaktor C3d ist und einen Kälteagglutinin-Titer von ≥ 1:64 bei 4 °C aufweist. Andere Erkrankungen, die einem sekundären Kälteagglutinin-Syndrom (CAS) zugrunde liegen, gilt es auszuschließen1.
Zum Nachweis von Kälteantikörpern wird ein direkter Antiglobulintest (DAT oder direkter Coombs-Test) durchgeführt1. Ein polyspezifischer Coombs-Test wird positiv ausfallen und der direkte monospezifische Coombs-Test (DAT) ist positiv für die Komplementkomponente C3d und im Allgemeinen negativ oder nur schwach positiv für IgG.12,25. Ein positiver DAT in Abwesenheit von Hämolysezeichen reicht für die Diagnose der CAD jedoch allein nicht aus¹¹.
Um die Diagnose einer Kälteagglutinin-Krankheit (CAD) zu bestätigen, sollte bei allen Patienten mit Verdacht auf CAD auch die Menge der Kälteagglutinine (durch Kälteantikörper agglutinierte Erythrozyten) bestimmt werden. Bei Patienten mit Kälteagglutinin-Krankheit (CAD) liegt der Kälteagglutinin-Titer bei 4 °C bei ≥ 1:64. In seltenen Fällen kann er jedoch auch < 1:64 betragen1. Kälteagglutinine binden in einem bestimmten Temperaturbereich an das Erythrozyten-Antigen. Die sogenannte Thermalamplitude ist die höchste Temperatur, bei der die Antikörper an das Antigen binden. Sie liegt bei den meisten klinisch bedeutsamen Kälteagglutininen über 28 °C und kann sich auch im Bereich der Körpertemperatur befinden26. Wichtig für den Nachweis von Kälteagglutininen ist, die Blutprobe nach der Blutentnahme bei 37 bis 38 °C zu halten, ansonsten wird ein falsch-niedriger Kälteautoantikörper-Titer gemessen27.
Da die Kälteagglutinin-Krankheit (CAD) auch als sekundäres Kälteagglutinin-Syndrom (CAS) auftreten kann (vgl. Abschnitt Einteilung), sind andere mögliche Krankheitsursachen wie lymphoproliferative Erkrankungen oder maligne Lymphome (z. B. ein Non-Hodgkin-Lymphom oder Morbus Waldenström), Infektionen sowie Autoimmunerkrankungen unbedingt auszuschließen. Dafür kommen klinische, histologische und ggf. radiologische Methoden zum Einsatz. Untersuchungen des Knochenmarks mittels Histologie bzw. Durchflusszytometrie sollten bei allen Patienten mit Kälteagglutinin-Krankheit (CAD) zum Zeitpunkt der Erstdiagnose und ggf. vor Beginn einer Therapie erfolgen¹.
Ziel der Therapie einer Kälteagglutinin-Krankheit (CAD) ist es, bei Patienten mit symptomatischer Hämolyse die hämolytische Aktivität zu reduzieren sowie u. U. den Hämoglobinspiegel zu stabilisieren bzw. anzuheben und den Transfusionsbedarf zu reduzieren. Bei vielen Patienten sollten auch kälteinduzierte Symptome (vgl. Abschnitt Klinik und Symptome) behandelt werden. Jede Therapie zielt auf eine verbesserte Lebensqualität der Patienten mit Kälteagglutinin-Krankheit (CAD) ab¹.
- Jäger U, et al. Blood Rev. 2020;41:100648.
- Berentsen S, et al. Hematol Oncol Clin North Am. 2015;29(3):455-471.
- Sharma K, et al. N Engl J Med. 2019;381(13):e27.
- Berentsen S. Hematology Am Soc Hematol Educ Program. 2016;2016(1):226-231.
- Mullins M, et al. Blood Adv. 2017;1(13):839-848.
- Bylsma LC, et al. Blood Adv. 2019;3(20):2980-2985.
- Broome C, et al. Blood. 2017;130(Suppl 1):928.
- Kamesaki T, et al. HemaSphere. 2019;3(Suppl 1):169.
- Hill QA, et al. Blood. 2019;134(Suppl 1):4790.
- Berentsen S, et al. Semin Haematol. 2018;55(3):141-149.
- Berentsen S, et al. Br J Haematol. 2018;181(3):320-330.
- Berentsen S, et al. Haematologica. 2006;91(4):460-466.
- Su J, et al. Value Health. 2019;22(Suppl 2):S348.
- Desbois AC, et al. Joint Bone Spine. 2019;86(6):707-713.
- Röth A, et al. Blood Adv. 2018;2(19):2543-2549.
- Randen U, et al. Haematologica. 2014;99(3):497-504.
- Jäger U, et al, Blood. 2019;133(9):893-901.
- Ulvestad E, et al. Scand J Immunol. 2001;54(1-2):239-242.
- Berentsen S, et al. Blood. 2020;136(4):480-488.
- Peerschke EI, et al. J Exp Med. 1993;178(2):579-587.
- Polley MJ, et al. J Exp Med. 1983;158(2):603-615.
- Hill QA, et al. Br J Haematol. 2017;176(3):395-411.
- Koike Y, et al. Indian J Dermatol Venereol Leprol. 2014;80(6):575-576.
- Lyckholm LJ, Edmond MB. N Engl J Med. 1996;334(7):437.
- Swiecicki PL, et al. Blood. 2013;122(7):1114-1121.
- Baines AC, Brodsky RA. Blood Rev. 2017;31(4):213-223.
- Salama A, et al. Nachweis von erythrozytären Antigenen und Antikörpern. In: Kiefel V (Hrsg.). Transfusionsmedizin und Immunhämatologie. Grundlagen – Therapie – Methodik. 4. Aufl. Berlin Heidelberg: Springer Verlag; 2011: 577-589.


.webp)