- Article
- Source: Campus Sanofi
Sobre a Esclerose Múltipla
A Esclerose Múltipla (EM) é uma doença crónica inflamatória do Sistema Nervoso Central (SNC), caracterizada pela desmielinização e neurodegeneração (perda axonal e morte neuronal) em diversos locais do cérebro e da medula espinal.1
As lesões da EM resultam da infiltração de células periféricas do sistema imunitário, que atravessam a barreira hematoencefálica (BHE) e promovem inflamação, desmielinização, gliose e neurodegeneração.2
A atrofia cerebral é observada desde o início da doença, tornando-se cada vez mais aparente com a evolução da doença, especialmente em fenótipos mais progressivos.3
A EM é uma causa comum de incapacidade física e cognitiva graves em jovens adultos.3
- Baecher‐Allan C, Kaskow BJ, Weiner HL. Multiple sclerosis: mechanisms and immunotherapy. Neuron. 2018;97(4):742‐768.
- Dendrou CA, Fugger L, Friese MA. Immunopathology of multiple sclerosis. Nat Rev Immunol. 2015;15(9):545‐558.
- Thompson AJ, Baranzini SE, Geurts J, et al. Multiple sclerosis. Lancet. 2018;391(10130):1622‐1636.
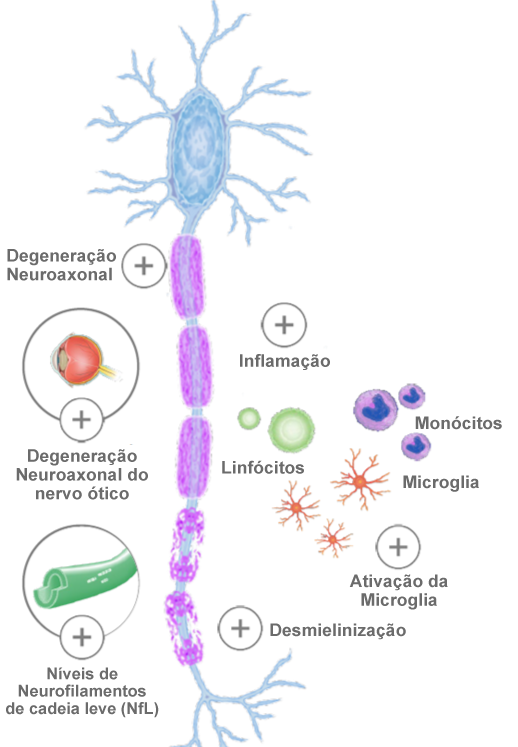
A fisiopatologia da Esclerose Múltipla
Neurodegeneração
A ativação da microglia, a disfunção mitocondrial, a excitotoxicidade do glutamato e a acumulação de ferro podem contribuir para um aumento do stress oxidativo nos neurónios.1
A evidência também suporta o efeito citotóxico direto das células T CD8+ nos axónios.2,3
A lesão dos axónios é aparente nas lesões crónicas ativas de doentes com EM cuja duração esteja entre os 2 meses e os 27 anos.4
A densidade axonal é reduzida até 80% em lesões crónicas. A patologia axonal foi demonstrada na substância branca de aparência normal e lesões com desmielinização, o que pode indicar que outros fatores para além da inflamação contribuem para a neurodegeneração.2,5 Potenciais mecanismos incluem a degeneração walleriana e a degeneração transneuronal retrógrada e anterógrada.2,6
- Azevedo CJ, Cen SY, Khadka S, et al. Thalamic atrophy in multiple sclerosis: a magnetic resonance imaging marker of neurodegeneration throughout disease. Ann Neurol. 2018;83(2):223‐234.
- Siffrin V, Vogt J, Radbruch H, et al. Multiple sclerosis – candidate mechanisms underlying CNS atrophy. Trends Neurosci. 2010;33(4):202‐210.
- Trapp BD, Nave KA. Multiple sclerosis: an immune or neurodegenerative disorder. Ann Rev Neurosci. 2008;31:247‐269.
- Trapp BD, Peterson J, Ransohoff RM, et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 1998;338(5):278‐285.
- Popescu BF, Pirko I, Lucchinetti CF. Pathology of multiple sclerosis: where do we stand? Continuum (Minneap Minn). 2013;19(4):901‐921.
- Simon JH. Brain atrophy in multiple sclerosis: what we know and would like to know. Mult Scler. 2006;12(6):679‐687.
Perda de Volume Cerebral
A atrofia cerebral tem início numa fase precoce da EM, progredindo mais rapidamente relativamente a pessoas saudáveis.1Nestas, regista-se uma perda de volume cerebral (PVC) entre 0,1 –e 0,3% ao ano, enquanto em doentes com EM a PVC varia entre 0,5 –e 1,35% ao ano.2
Na substância branca, a PVC mantém uma taxa constante ao longo das diferentes fases da doença. Por outro lado, na substância cinzenta, há um aumento significativo da perda de volume cerebral por ano nas formas progressivas da doença, podendo alcançar uma perda 14 vezes superior ao que seria esperado num indivíduo saudável.3
A atrofia cerebral representa os efeitos do dano no tecido e da neurodegeneração resultantes de lesões focais (evidenciadas em RM) e difusas.4
A taxa de atrofia cerebral total nas fases iniciais da doença pode ajudar a prever o grau de incapacidade a longo prazo.5,6 A evidência sugere que um declínio cognitivo no início da doença está relacionado com a perda de volume de parênquima cerebral, mas não com a carga de lesões em T1 ou T2.7-9 A redução do volume cerebral total ou do volume da substância cinzenta neocortical está relacionada com a incapacidade cognitiva em doentes com EMSR.1
Como avaliar
Entre as várias técnicas disponíveis para avaliar através de RM alterações no volume cerebral, existem duas que são mais reconhecidas: a Brain parenchymal fraction (BPF) e a Structured image evaluation using normalization of atrophy (SIENA).
A BPF mede o volume cerebral a partir de uma única ressonância.1 A SIENA utiliza um algoritmo que segmenta as regiões com tecido cerebral em dois momentos distintos, permitindo perceber qual a diferença de volume entre esses dois pontos temporais.11
Utilização como outcome
Atualmente, a perda de volume cerebral total é utilizada como outcome secundário e a atrofia regional (ex.: atrofia do tálamo) como outcome exploratório, em ensaios clínicos de Fase III.12
- Rudick RA, Fisher E, Lee JC, et al. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing‐remitting MS. Multiple Sclerosis Collaborative Research Group. Neurology. 1999;53(8):1698‐1704.
- De Stefano N, Airas L, Grigoriadis N, et al. Clinical relevance of brain volume measures in multiple sclerosis. CNS Drugs. 2014;28(2):147‐156.
- Fisher E, Lee JC, Nakamura K, et al. Gray matter atrophy in multiple sclerosis: a longitudinal study. Ann Neurol. 2008;64(3):255‐265.
- Riley C, Azevedo C, Bailey M, et al. Clinical applications of imaging disease burden in multiple sclerosis: MRI and advanced imaging techniques. Expert Rev Neurother. 2012;12(3):323‐333.
- Rudick RA, Fisher E, Lee JC, et al. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing‐remitting MS. Multiple Sclerosis Collaborative Research Group. Neurology. 1999;53(8):1698‐1704.
- Popescu V, Agosta F, Hulst HE, et al. Brain atrophy and lesion load predict long term disability in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2013;84(10):1082‐1091.
- Calabrese, MAgosta F, Rinaldi F, et al. Cortical lesions and atrophy associated with cognitive impairment in relapsing‐remitting multiple sclerosis. Arch Neurol. 2009;66(9):1144‐1150.
- Fisher E, Lee JC, Nakamura K, et al. Gray matter atrophy in multiple sclerosis: a longitudinal study. Ann Neurol. 2008;64(3):255‐265.
- Smith SM, Zhang Y, Jenkinson M, et al. Accurate, robust, and automated longitudinal and cross‐sectional brain change analysis. Neuroimage. 2002;17(1):479‐489.
- Zivadinov R, Sepcic J, Nasuelli D, et al. A longitudinal study of brain atrophy and cognitive disturbances in the early phase of relapsing‐remitting multiple sclerosis. J Neurol Neurosurg Psychiatry. 2001;70(6):773‐780.
- Smith SM et al. Accurate, robust, and automated longitudinal and cross-sectional brain change analysis. Neuroimage. 2002;17(1):479-89.
- van Munster CE, Uitdehaag BM. Outcome measures in clinical trials for multiple sclerosis. CNS Drugs. 2017;31(3):217‐236.
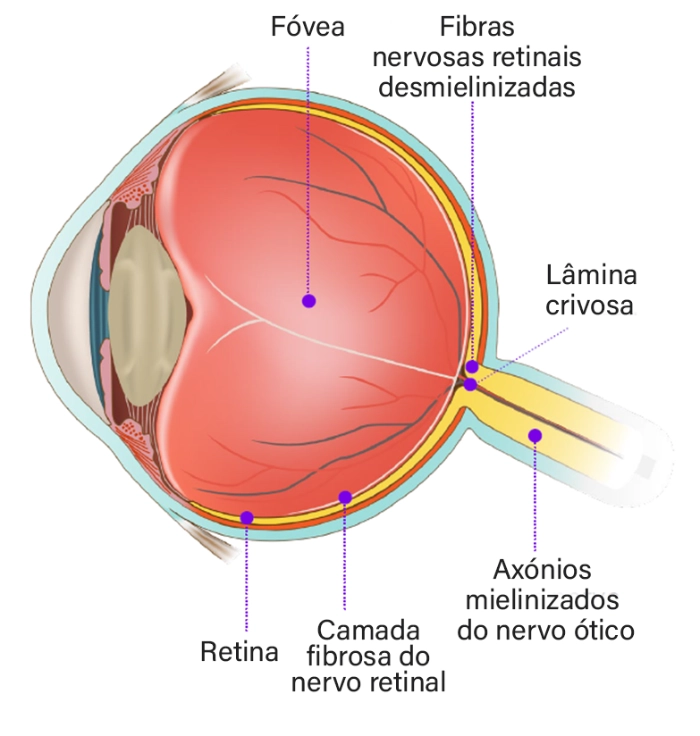
Neurodegeneração do nervo ótico
O nervo ótico e a retina são considerados partes integrantes do SNC.1
Na EM, é muito comum o envolvimento do nervo ótico, clínica ou subclinicamente. Nos exames post-mortem, 94 –a 99% dos doentes com EM tinham lesões desmielinizantes no nervo ótico.2
- Gupta S, Zivadinov R, Ramanathan M, et al. Optical coherence tomography and neurodegeneration: are eyes the windows to the brain? Expert Rev Neurother. 2016;16(7):765-775.
- Saidha S, Al‐Louzi O, Ratchford JN, et al. Optical coherence tomography reflects brain atrophy in multiple sclerosis: a four‐year study. Ann Neurol. 2015;78(5):801‐813.
Neuroinflamação
As células T e B autorreativas são ativadas por células apresentadoras de antigénios na periferia. Quando ativadas, a sobre-regulação de moléculas de adesão, a produção de citocinas pró-inflamatórias e a secreção de enzimas permitem que as células T e B penetrem o SNC, atravessando a barreira hematoencefálica.1-4
Quando dentro do SNC, as células T e B autorreativas são novamente estimuladas por autoantigénios, o que pode contribuir para o dano na bainha de mielina e dos axónios.1,2 Tem sido demonstrada a contribuição das células B e T para a fisiopatologia subjacente da EM.5,6
As células B e T reguladoras podem balancear a resposta imunitária ao libertar citocinas anti-inflamatórias.7 No entanto, estas células parecem estar comprometidas na EM.7
Na EM, um número inferior de células T-reg e um número superior de células T CD4+ e T CD8+ contribuem para a inflamação.7
Em fases mais avançadas da doença, a inflamação persiste com um menor número de células invasoras observadas nas lesões. Estruturas linfoides terciárias podem formar-se nas meninges e podem contribuir para a desmielinização cortical e dano no tecido.8
- Sospedra M, Martin R. Immunology of multiple sclerosis. Ann Rev Immunol. 2005;23:683‐747.
- Wu GF, Alvarez E. The immunopathophysiology of multiple sclerosis. Neurol Clin. 2011;29(2):257‐278.
- Comabella M, Khoury SJ. Immunopathogenesis of multiple sclerosis. Clin Immunol. 2012;142(1):2‐8.
- Minagar A, Alexander JS. Blood‐brain barrier disruption in multiple sclerosis. Mult Scler. 2003;9(6):540‐549.
- Tuosto L. Targeting inflammatory T cells in multiple sclerosis: current therapies and future challenges. Austin J Mult Scler Neuroimmunol. 2015;2(1):1009.
- Lehmann‐Horn K, Kronsbein HC, Weber MS. Targeting B cells in the treatment of multiple sclerosis: recent advances and remaining challenges. Ther Adv Neurol Disord. 2013;6(3):161‐173.
- Baecher‐Allan C, Kaskow BJ, Weiner HL. Multiple sclerosis: mechanisms and immunotherapy. Neuron. 2018;97(4):742‐768.
- Howell OW, Reeves CA, Nicholas R, et al. Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis. Brain. 2011;134:2755‐2771.
Desmielinização
Os oligodendrócitos revestem os neurónios com mielina, uma membrana lipídica com várias camadas, que acelera a propagação dos potenciais de ação e fornece suporte estrutural e metabólico.1
Na EM, áreas onde ocorre desmielinização devido à inflamação estão presentes nas substâncias branca e cinzenta.2 O dano na mielina é causado por células T e B autorreativas que invadem o SNC, bem como por células residentes do SNC, como a microglia e macrófagos.2
A desmielinização aguda e crónica contribui para o dano axonal e neurodegeneração.3
A inflamação crónica do SNC está associada a uma expansão lenta de lesões pré-existentes na substância branca e a uma neurodegeneração difusa das substâncias branca e cinzenta de aparência normal.4
Quando a neuroinflamação diminui, pode ocorrer a remielinização de axónios danificados.5 No entanto, este processo é, geralmente, incompleto e a capacidade de remielinização diminui com a idade e a progressão da doença.5
- Nave KA, Werner HB. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 2014;30:503-33.
- Baecher-Allan C, Kaskow BJ, Weiner HL. Multiple Sclerosis: Mechanisms and Immunotherapy. Neuron. 2018 Feb 21;97(4):742-768.
- Reich DS, Lucchinetti CF, Calabresi PA. Multiple Sclerosis. N Engl J Med. 2018 Jan 11;378(2):169-180.
- Lassmann H. Pathogenic Mechanisms Associated With Different Clinical Courses of Multiple Sclerosis. Front Immunol. 2019 Jan 10;9:3116.
- Franklin RJM, Ffrench-Constant C. Regenerating CNS myelin - from mechanisms to experimental medicines. Nat Rev Neurosci. 2017 Nov 16;18(12):753-769.
Microglia
A microglia constitui o conjunto de células imunitárias residentes mais abundantes do SNC e monitorizam-no constantemente.1,2 Estão envolvidas na libertação de mediadores inflamatórios (TNF, óxido nítrico e mieloperoxidase) e na alteração da reabsorção do glutamato, o que, consequentemente, conduz a dano neuronal e sináptico, devido à excitotoxicidade.3
A microglia é morfologicamente e funcionalmente semelhante aos monócitos; a contribuição de cada uma destas células para a fisiopatologia da EM ainda não é totalmente conhecida.1
A ativação da microglia ocorre no início do desenvolvimento de lesões no SNC.4 O número de células da microglia ativadas e o grau de ativação estão relacionados com o nível de dano neurológico em lesões da substância cinzenta.3
A microglia ativada contribui para a ativação inicial e para a reestimulação de células T infiltradas.4 As células T produzem, por sua vez, citocinas que influenciam a ativação da microglia e a produção de citocinas.4
Em lesões ativas, a microglia está localizada no limite da lesão e vai diminuindo à medida que acontece uma maturação da lesão.5 Em lesões de expansão lenta smoldering, a microglia está mais restrita ao limite da lesão ativa. Lesões smoldering crónicas estão relacionadas com a progressão subclínica da incapacidade e com a ativação contínua da microglia mais restrita ao limite das lesões.6
- O’Loughlin E, Madore C, Lassmann H, et al. Microglial phenotypes and functions in multiple sclerosis. Cold Spring Harb Perspect Med. 2018;8(2):a028993.
- Kathryn M. Lenz and Lars H. Nelson. Microglia and Beyond: innate immune Cells As Regulators of Brain Development and Behavioral Function. Front Immunol. 2018;13; 698.
- Calabrese M, Magliozzi R, Ciccarelli O, et al. Exploring the origins of grey matter damage in multiple sclerosis. Nat Rev Neurosci. 2015;16:147-158.
- Legroux L, Arbour N. Multiple sclerosis and T lymphocytes: an entangled story. J Neuroimmune Pharmacol. 2015;10(4):528‐546.
- Zrzavy T, Hametner S, Wimmer I, et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 2017;140:1900-1913.
- Reich DS, Lucchinetti CF, Calabresi PA. Multiple sclerosis. N Engl J Med. 2018;378(2):169‐180.
Neurofilamentos
Os neurofilamentos de cadeia leve (NfL) representam um dos principais constituintes do citoesqueleto neuronal e desempenham um papel importante no crescimento axonal, estabilidade e transporte intracelular.1
As proteínas dos NfL podem transpor para o líquido cefalorraquidiano (LCR), onde se tornam detetáveis em concentrações baixas no sangue periférico.2
Importância clínica
Níveis elevados de NfL no sangue foram observados na EM e noutras doenças neurodegenerativas.2
A presença de NfL no LCR foi correlacionada com atrofia cerebral num estudo a longo prazo com 15 doentes com EMSR, EMPP ou EMSP.3 A presença de NfL no sangue foi relacionada com futuro agravamento da pontuação de EDSS numa coorte de 246 doentes com EMSR, EMPP ou EMSP.2
O volume de lesões em T2 está altamente associado ao nível de NfL no sangue.1
As limitações de utilizar os NfL como biomarcador incluem a falta de procedimentos harmonizados para o processamento e análise da amostra e a sua baixa especificidade para a EM.4
- Barro C, Benkert P, Disanto G, et al. Serum neurofilament as a predictor of disease worsening and brain and spinal cord atrophy in multiple sclerosis. Brain. 2018;141(8):2382-2391.
- Disanto G, Barro C, Benkert P, et al. Serum neurofilament light: a biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 2017;81(6):857‐870.
- Petzold A, Steenwijk MD, Eikelenboom JM, et al. Elevated CSF neurofilament proteins predict brain atrophy: a 15‐year follow‐up study. Mult Scler. 2016;22(9):1154‐1162.
- Kapoor R et al. Serum neurofilament light as a biomarker in progressive multiple sclerosis. Neurology. 2020;95:436-444.
MAT-PT-2300883 |V1.0 | Setembro de 2023