- Article
- Source: Campus Sanofi
Dạng Bào Chế Phóng Thích Kéo Dài Alfuzosin Xl 10 Mg: Khác Biệt Giữa Thuốc Phát Minh Với Các Thuốc Generic


Dạng Bào Chế Phóng Thích Kéo Dài Alfuzosin Xl 10 Mg:
Khác Biệt Giữa Thuốc Phát Minh Với Các Thuốc Generic
01. Alfuzosin Được Khuyến Cáo Là Một Lựa Chọn Đầu Tay Trong Điều Trị Triệu Chứng Đường Tiểu Dưới Do Tăng Sinh Lành Tính Tuyến Tiền Liệt
Nhiều nghiên cứu pha 3 then chốt của các chẹn thụ thể α1 (chẹn α1) khác nhau đã cho thấy khả năng cải thiện vượt trội hơn so với giả dược về triệu chứng rối loạn đường tiểu dưới (LUTS) do tăng sinh lành tính tuyến tiền liệt (BPH) theo thang điểm quốc tế triệu chứng tuyến tiền liệt (IPSS), gia tăng niệu dòng đỉnh (Qmax), cải thiện chất lượng sống (QoL) liên quan bệnh và có hồ sơ dung nạp an toàn. Vì vậy, theo khuyến cáo của Hội Tiết Niệu châu Âu (EAU) và của Hội Tiết niệu Thận học Việt Nam (VUNA), chẹn α1 là một lựa chọn đầu tay trong điều trị LUTS/BPH.
Alfuzosin là chẹn α1 đã được đánh giá qua nhiều nghiên cứu lâm sàng, ngẫu nhiên, đối chứng với giả dược trên bệnh nhân LUTS/BPH, với các lợi ích chính:
- Giảm nhanh triệu chứng: Cải thiện Qmax trong 1.5 giờ sau một liều alfuzosin 2.5 mg đáng kể hơn về hiệu quả điều trị so với giả dược (34% so với 7.5%).
- Duy trì hiệu quả lâu dài: Cải thiện đáng kể triệu chứng so với giả dược sau 1 tháng điều trị với alfuzosin 5 mg x 2 lần/ngày và có khuynh hướng tốt hơn theo thời gian (P < 0.01).
- An toàn: Alfuzosin ít xảy ra tác dụng ngoại ý liên quan tim mạch và liên quan hoạt động tình dục.
Dựa vào những lợi ích điều trị này của alfuzosin 2.5 mg x 3 lần/ngày và 5 mg x 2 lần/ngày trên bệnh nhân LUTS/BPH, một dạng bào chế mới là dạng phóng thích kéo dài (XL) sử dụng 1 lần/ngày, không cần chỉnh liều đã được phát triển. Mục tiêu của dạng bào chế này nhằm giúp (1) Duy trì hiệu quả ổn định trong suốt 24 giờ;(2) Cải thiện tính tuân thủ điều trị ở bệnh nhân; (3) Tối ưu tính an toàn của alfuzosin trong điều trị LUTS/BPH.
02. Hiệu Quả Và Tính an toàn Của Alfuzosin Dạng Bào Chế Phóng Thích Kéo Dài Sử Dụng 1 Lần/ngày Trong Điều Trị Luts/bph
Alfuzosin XL 10 mg dùng ngày 1 lần đã chứng minh khả năng kiểm soát LUTS/BPH trong suốt 24 giờ và hiệu quả kéo dài đến 1 năm.
Trong một nghiên cứu mù đôi, đối chứng với giả dược trên 372 bệnh nhân tuổi từ 50 trở lên với chẩn đoán BPH có triệu chứng với mức độ trung bình – nặng, điều trị với alfuzosin 10 mg/ngày giúp cải thiện đáng kể Qmax ngay sau tuần điều trị đầu tiên (p < 0.021 so với giả dược, hình 1) với hiệu quả ổn định trong 24 giờ sau liều đầu tiên và duy trì trong suốt 29 ngày điều trị (p < 0.001).
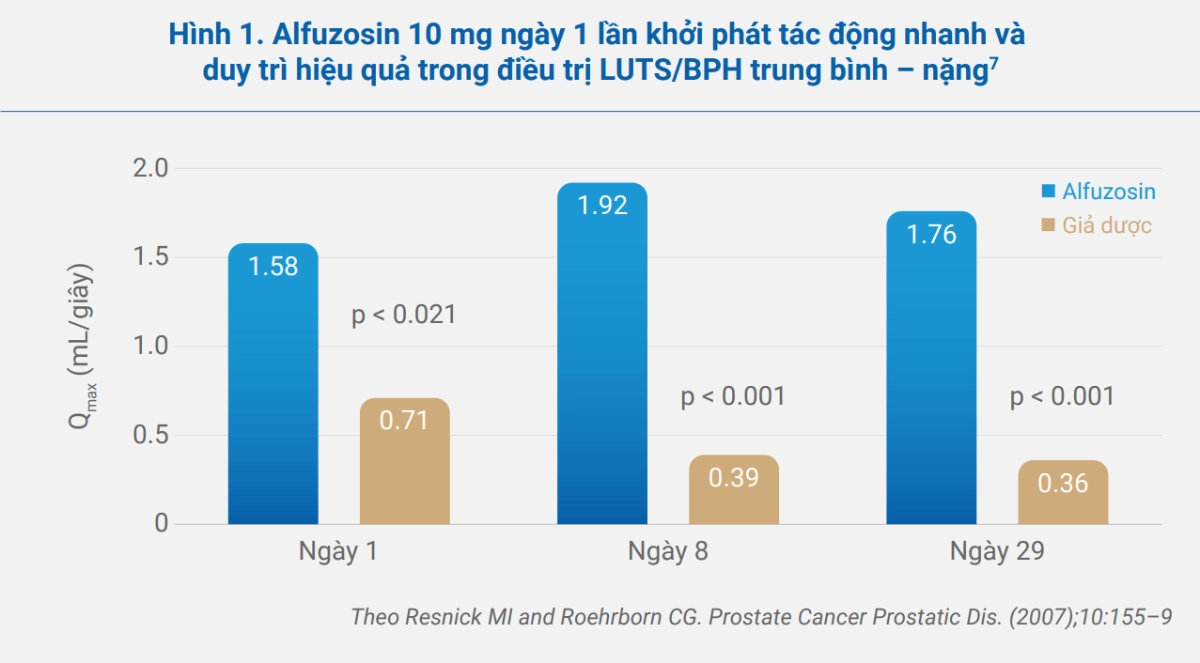
Nghiên cứu ALFORTI là một nghiên cứu quy mô lớn, thiết kế chuẩn, mù đôi, đối chứng với giả dược, so sánh với alfuzosin XL 10 mg x 1 lần/ngày với alfuzosin 2.5 mg x 3 lần/ngày trong thời gian 3 tháng trên bệnh nhân LUTS/BPH trung bình – nặng.
- Kết quả cho thấy alfuzosin XL 10 mg x 1 lần/ngày cải thiện có ý nghĩa thống kê so với giả dược và có hiệu quả tương đương với alfuzosin 2.5 mg x 3 lần/ngày về IPSS, Qmax và QoL trên bệnh nhân LUTS/BPH.
- Trong phân tích mở rộng từ dữ liệu ALFORTI, không mù, kéo dài thêm 9 tháng, sự cải thiện kiểm soát triệu chứng LUTS theo IPSS của alfuzosin XL 10 mg x1 lần/ngày tiếp tục được ghi nhận.
Điều quan trọng là bên cạnh khả năng duy trì hiệu quả ổn định, alfuzosin XL 10 mg ngày 1 lần không làm thay đổi các thông số huyết động so với ban đầu ở người bình thường cũng như người có tăng huyết áp. Nhìn chung, alfuzosin 10 mg ngày 1 lần dung nạp tốt hơn so với alfuzosin 2.5 mg x3 lần/ngày, đặc biệt là tần suất tác dụng ngoại ý liên quan giãn mạch (hình 2).
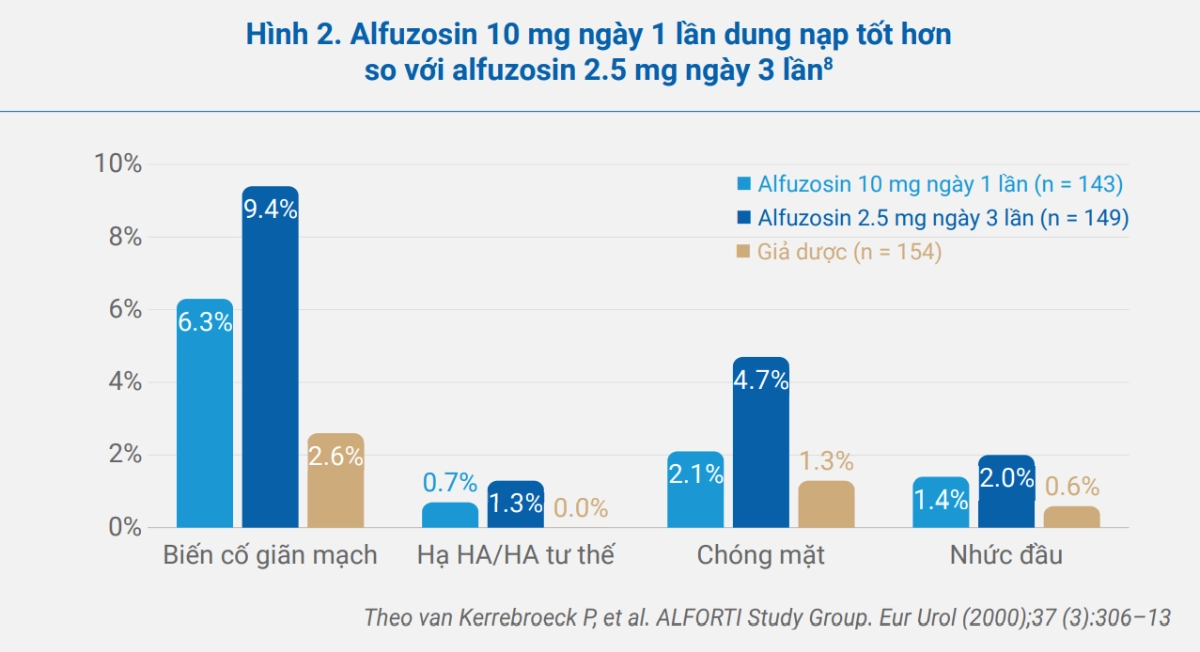
Mức giảm huyết áp tư thế ở nhóm alfuzosin XL 10 mg ngày 1 lần không khác biệt có ý nghĩa lâm sàng so với giả dược cũng như so với nhóm alfuzosin 2.5 mg ngày 3 lần (hình 3).
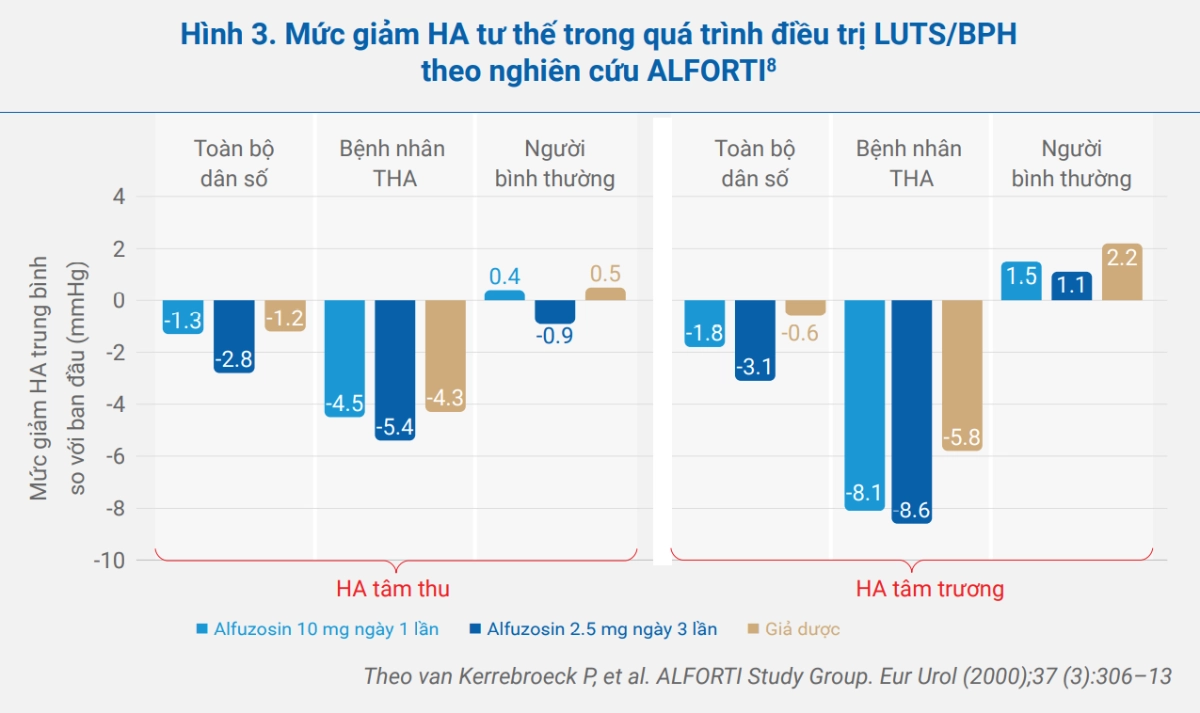
Alfuzosin 10 mg ngày 1 lần cũng được đánh giá qua nghiên cứu đời thực ALF-ONE. Kết quả cho thấy điều trị LUTS/BPH với allfuzosin 10 mg x1 lần/ngày dài hạn trong 3 năm vẫn duy trì hiệu quả và dung nạp an toàn về tim mạch và chức năng tình dục.
03. Công Nghệ Bào Chế Alfuzosin Dạng Phóng Thích Kéo Dài Có Gì Đặc Biệt?
Alfuzosin dạng bào chế phóng thích kéo dài (XL) sử dụng công nghệ bào chế GEOMATRIX với khung matrix 3 lớp gồm lớp thuốc có hoạt tính ở giữa 2 lớp không có hoạt tính (một lớp phồng và một lớp bào mòn). Các lớp không hoạt tính có nhiệm vụ kiểm soát tốc độ hòa tan của thuốc.
- Trong các lớp không hoạt tính, các polyme thân nước phồng lên khi tiếp xúc với dịch làm tăng khả năng tồn tại ở dạ dày và phóng thích alfuzosin liên tục trong suốt thời gian dùng thuốc (hình 4).
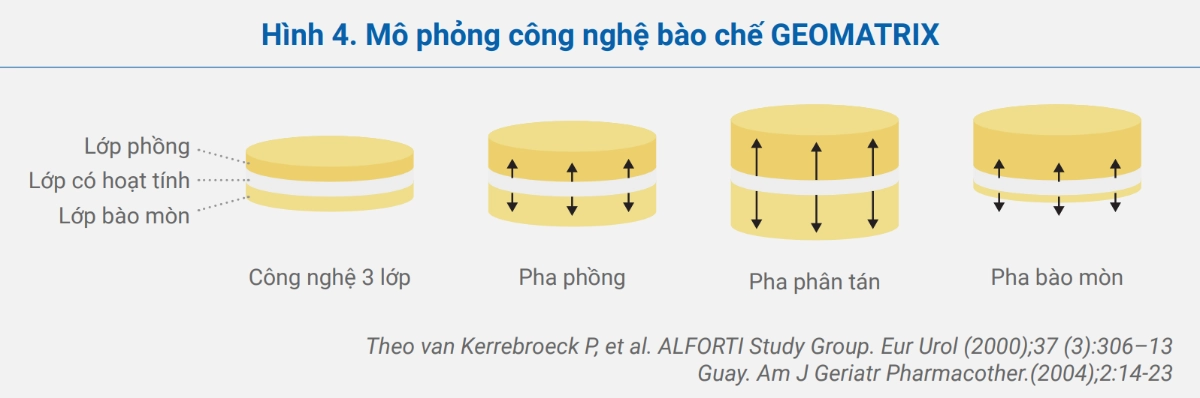
- Thuốc được phóng thích duy trì trong 20 giờ với tốc độ hòa tan gần như không đổi trong khoảng thời gian 2 – 12 giờ.
Với công nghệ bào chế GEOMATRIX, alfuzosin XL 10 mg x 1 lần/ngày có hồ sơ dược động học tương đương với các dạng bào chế phóng thích nhanh (alfuzosin 2.5 mg) và phóng thích chậm (alfuzosin 5 mg) khi dùng thuốc sau bữa ăn (Bảng 1).
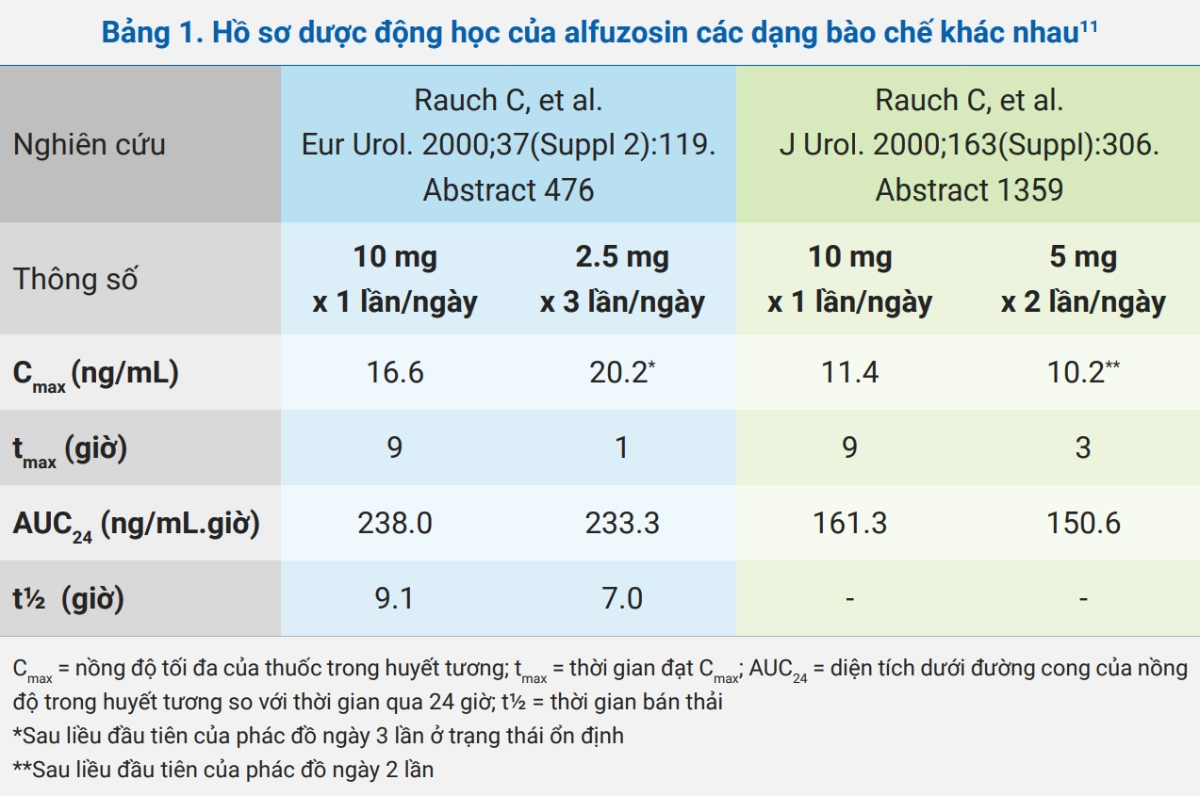
Hồ sơ an toàn của alfuzosin XL có lẽ đạt được nhờ vào công nghệ bào chế và đặc điểm dược động học, đặc biệt là nồng độ thuốc trong huyết tương bình nguyên hơn với dạng phóng thích kéo dài.
Dữ liệu dược động học của alfuzosin XL 10 mg cũng được ghi nhận không có khác biệt đáng kể ở người tình nguyện khỏe mạnh so với người cao tuổi và người có suy thận.
04. Khi Thuốc Generic Thay Thế Cho Thuốc Phát Minh: Điều Gì Cần Quan Tâm Đối Với Thuốc Có Dạng Bào Chế Đặc Biệt?
Thuốc generic là một thuốc thành phẩm được sản xuất không có giấy phép nhượng quyền của công ty phát minh và được đưa ra thị trường sau khi bằng phát minh và các độc quyền của thuốc phát minh (thuốc biệt dược gốc) hết thời hạn.
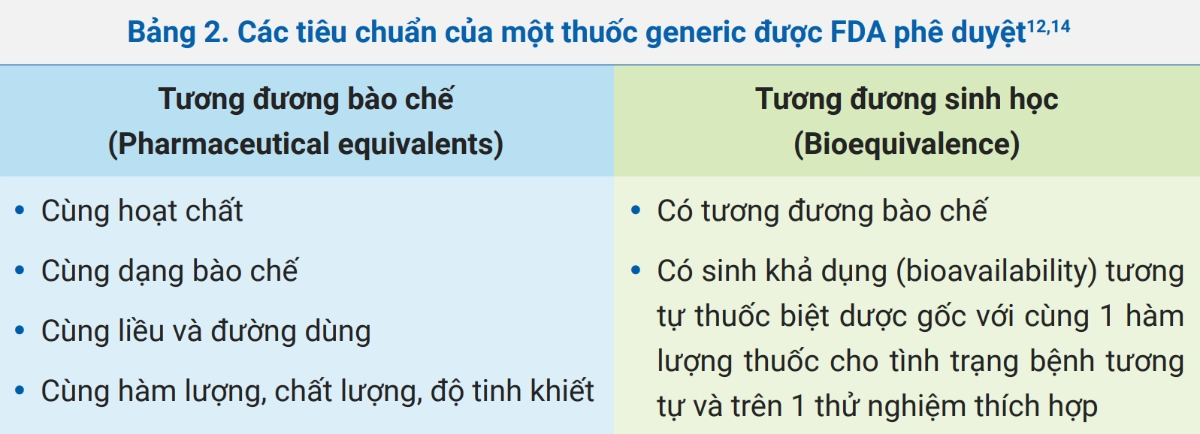
Theo Cục Quản lý Dược phẩm Thực phẩm Hoa Kỳ (FDA), thuốc generic được phê duyệt phải có tương đương bào chế và được chứng minh tương đương sinh học với thuốc biệt dược gốc (bảng 2). Và FDA xem thuốc generic được phê duyệt là có tính tương đương điều trị với thuốc biệt dược gốc này.
Điều cần lưu ý là FDA xem xét và phê duyệt thuốc generic theo quy trình đăng ký thuốc mới rút gọn (ANDA). Quy trình này không đòi hỏi đầy đủ các dữ liệu tiền lâm sàng (trên động vật) và lâm sàng (trên người) chứng minh tính an toàn và hiệu quả của thuốc như khi áp dụng với thuốc biệt dược gốc (bảng 3). Ngoài ra, đối tượng nghiên cứu là người khỏe mạnh thường trong độ tuổi 18 – 55, không dùng đồng thời với các thuốc khác, có một chế độ sống lành mạnh: không hút thuốc, dinh dưỡng hợp lý… Vì vậy, hồ sơ dược động học của thuốc ở người khỏe mạnh có thể không tiên đoán chính xác các đặc điểm dược động học của thuốc trên bệnh nhân. Hơn nữa, hồ sơ dược động học của thuốc cũng có thể bị tác động bởi các thuốc dùng đồng thời, tình trạng hút thuốc lá, chế độ ăn…

Tại Việt Nam, thông tư hướng dẫn của Bộ Y tế (08/2010) về quy trình đăng ký lưu hành thuốc đã nhấn mạnh việc hồ sơ đăng ký thuốc lưu hành tại Việt Nam phải áp dụng theo hồ sơ kỹ thuật chung ASEAN. Theo đó, khi đăng ký với dạng bào chế phóng thích kéo dài của thuốc biệt dược gốc, thuốc generic tương đương cần phải được thực hiện các nghiên cứu về:
(1) sinh khả dụng hoặc tương đương sinh học so với thuốc biệt dược gốc tương ứng mà thuốc generic này đang xem xét dự định thiết kế để tương đương.
(2) ảnh hưởng của thức ăn lên sinh khả dụng của thuốc.
Các nghiên cứu đánh giá này phải được thiết kế và thực hiện theo các quy định trong Hướng dẫn nghiên cứu sinh khả dụng/tương đương sinh học ASEAN hoặc các hướng dẫn tương đương của các tổ chức khác như Tổ Chức Y Tế Thế Giới (WHO), Hội Nghị Quốc Tế về Hòa Hợp (ICH), Cơ Quan Quản Lý Dược Thực Phẩm Mỹ (US FDA).
Có thể thấy rằng, việc chỉ dựa trên nghiên cứu đánh giá tương đương sinh học trên người khỏe mạnh để phê duyệt, thuốc generic chưa được đánh giá hồ sơ dược động học riêng trên đối tượng bệnh nhân mà thuốc có chỉ định, cũng như các dữ liệu tiền lâm sàng và lâm sàng như thuốc biệt dược gốc đã được chứng minh. Do đó, các nhà lâm sàng nên cân nhắc khi ra quyết định lựa chọn thuốc hiệu quả và an toàn trong điều trị cho từng bệnh cảnh lâm sàng riêng biệt.
LUTS = Lower Urinary Tract Symptoms; BPH = Benign Prostatic Hyperplasia; IPSS = International Prostate Symptom Score; QoL = Quality of Life; EAU = European Association of Urology; VUNA = Vietnam Urology & Nephrology Association.
- Roehrborn CG. Rev Urol. (2009); 11(suppl 1):S1–S8;
- Gravas S et al. EAU guideline on Management of Non-Neurogenic Male LUTS, incl. BPO. © European Association of Urology 2021;
- Hội Tiết niệu Thận học Việt Nam. Hướng dẫn chấn đoán và điều trị tăng sinh lành tính tuyến tiền liệt. Nhà xuất bản Y học 2019;
- Teillac P, et al. Br J Urol (1992);70:58–64;
- Buzelin JM, et al. ALGEBI Group. Eur Urol (1997);31 (2): 190–8;
- Debruyne FMJ, et al. Eur Urol (1998);34:169–75;
- Resnick MI and Roehrborn CG. Prostate Cancer Prostatic Dis. (2007);10:155–9;
- van Kerrebroeck P, et al. ALFORTI Study Group. Eur Urol (2000);37 (3):306–13;
- van Kerrebroeck P, et al. Eur Urol (2002);41 (1): 54–61;
- Vallancien et al. BJU Int (2008);101: 847–52;
- Guay. Am J Geriatr Pharmacother.(2004);2:14-23;
- Generic Drug Facts. Available at https://www.fda.gov/drugs/generic-drugs/generic-drug-facts;
- Bộ Y tế. Thông tư hướng dẫn báo cáo số liệu nghiên cứu sinh khả dụng/tương đương sinh học trong đăng ký thuốc. Số 08/2010/TT-BYT ngày 26/04/2010;
- Approved Drug Products with Therapeutic Equivalence Evaluations. 41st ed. Food and Drug Administration. Center for Drug Evaluation and Research.Available at https://www.fda.gov/drugs/development-approval-process-drugs/orangebook-preface;
- Types of Applications. Available at https://www.fda.gov/drugs/how-drugs-are-developed-and-approved/types-application.




