건강한 신생아 및 영아에서 RSV 관련 하기도 감염으로 인한 입원 예방에 있어 Nirsevimab의 효능과 안전성
Nirsevimab for Prevention of Hospitalizations Due to RSV in Infants
S.B. Drysdale, K. Cathie, F. Flamein, M. Knuf, A.M. Collins, H.C. Hill, F. Kaiser, R. Cohen, D. Pinquier, C.T. Felter, N.C. Vassilouthis, J. Jin, M. Bangert, K. Mari, R. Nteene, S. Wague, M. Roberts, P. Tissières, S. Royal, and S.N. Faust, for the MELODY Study Group. N Eng J Med. 2023; 389: 2425–2435.
.webp/jcr:content/10.%20DRIVE-THRU%20ARTICLE_MO.jpg)
건강한 신생아 및 영아를 대상으로 베이포투스™(Nirsevimab)의 안전성과 호흡기 RSV 관련 하부 호흡기 감염에 대한 입원 발생률에 대한 유효성을 평가하였습니다.
Methods
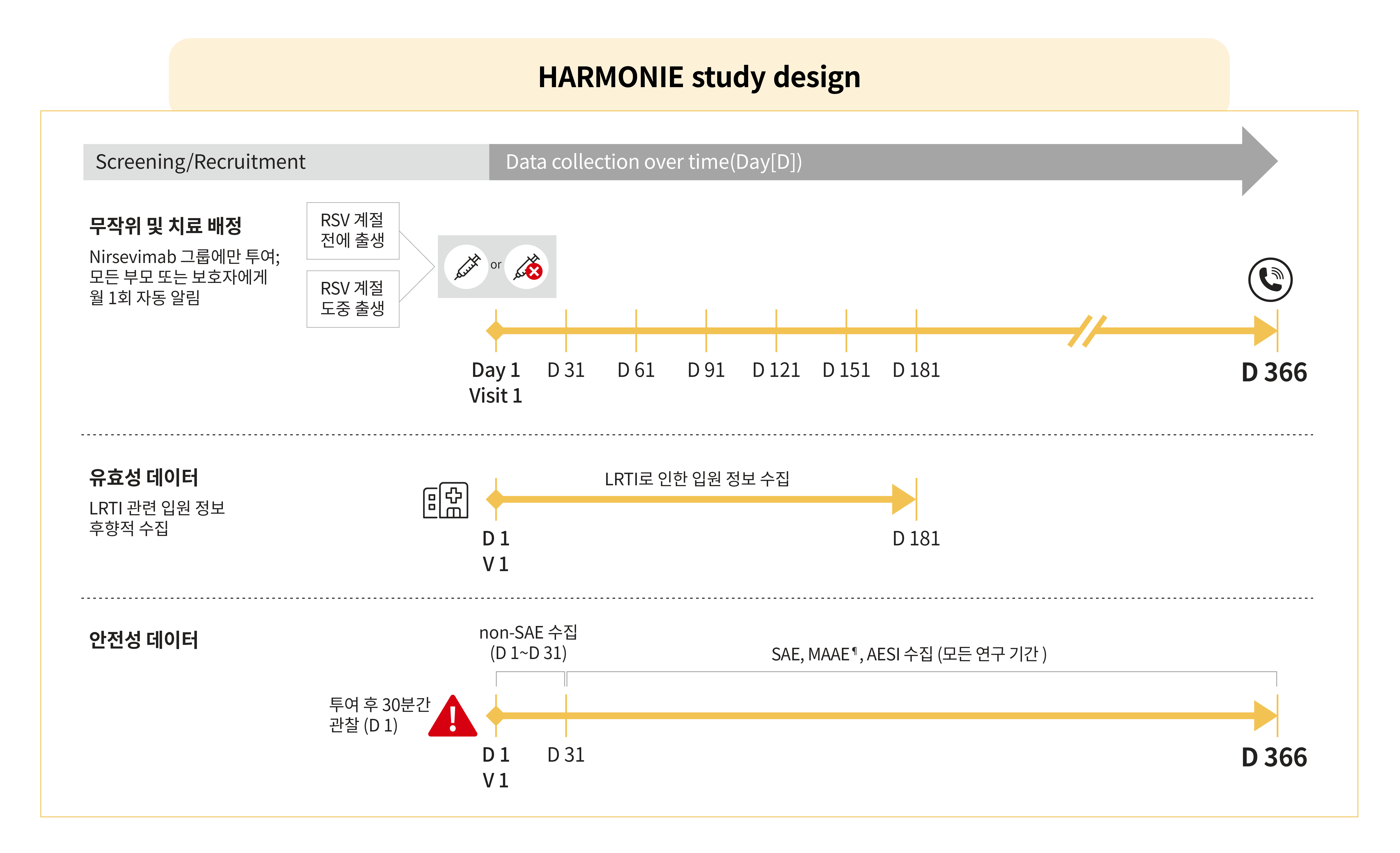
- 오픈라벨, 비맹검, 무작위, 다기관 2개군 평행설계 임상 연구
- 생후 첫 RSV 계절에 진입하는 8,058명의 생후 12개월 이하의 건강한 신생아 및 영아(재태 기간 29주 이상)를 베이포투스™ 1(n=4,037): 표준치료* 1(n=4,021)의 비율로 무작위 배정하였습니다.
- 첫 번째 RSV 계절을 맞이한 신생아 및 영아에게 RSV 계절 전 또는 RSV 계절 중에 베이포투스™를 단회 근육 내 투여하였습니다.
- 베이포투스™ 그룹: 5 kg 미만인 경우 50mg, 5kg 이상인 경우 100mg
- 표준치료* 그룹: 중재 없음(no intervention) - 투여 후 365일 동안 RSV 하기도 감염으로 인한 입원 치료의 발생을 포함한 이상사례에 대해 모니터링 하였습니다.
- 신생아 및 영아의 건강 상태는 전자 보고서를 통해 수집되었습니다.
- 부모 및 보호자는 첫 6개월간 매 월 신생아 및 영아의 건강 상태를 기록하였습니다.
- 첫 6개월 이 후에 발생 한 모든 이상사례에 대한 정보는 366일차에 전화로 수집되었습니다. - 하기도 감염으로 인해 입원을 하게된 경우 RSV 감염 여부 확인을 위한 진단검사를 진행하였습니다.
- 1차 평가변수: RSV 계절동안 RSV로 유발된 하기도 감염으로 인한 입원 발생률†
- 2차 평가변수: RSV 계절동안
- 매우 중증의 RSV로 유발된 하기도 감염으로 인한 입원‡
- 국가별 RSV로 유발된 하기도 감염으로 인한 입원
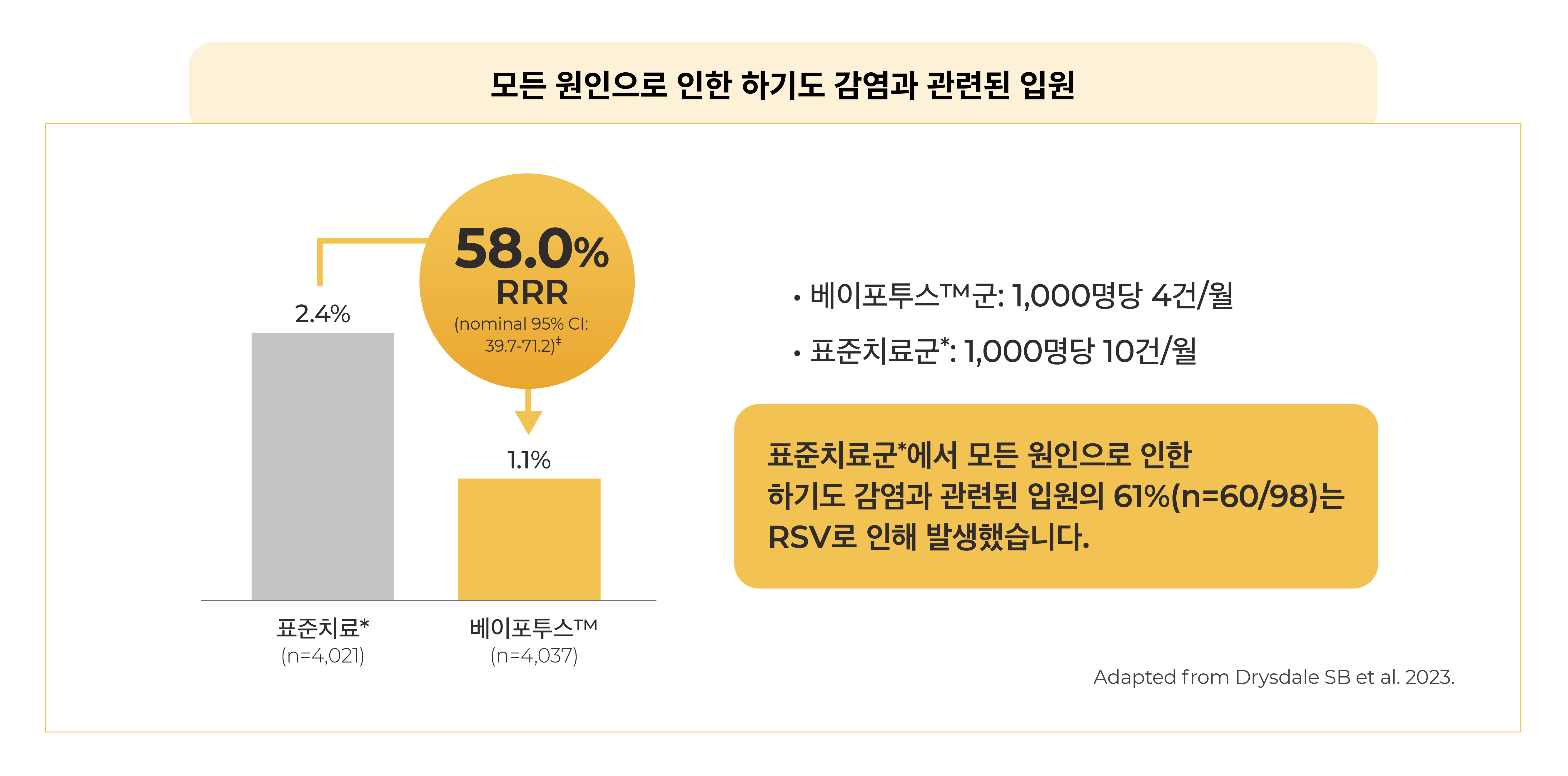
- 모든 원인으로 인한 하기도 감염과 관련된 입원 - 안전성 평가: 중대하지 않은 이상사례는 31일간, 이상사례(AE), 중대한 이상사례(SAE), 특별 관심 대상의 이상사례(AESI), 의학적 관리가 수반되는 이상사례(MAAE¶)는 12개월 동안 평가되었습니다.
- 특별 관심 대상의 이상사례(AESI)는 아나필락시스, 면역 복합체 질환, 혈소판 감소증을 포함한 과민 반응이었습니다.
- 의학적 관리가 수반되는 이상사례(MAAE¶)는 신생아 및 영아가 건강상의 이유로 계획되지 않은 병원 진료를 받게 된 경우였습니다.
Results
참가자 기저 특징
- 대부분의(3,998명[99.6%]) 신생아 및 영아는 RSV 계절동안 Nirsevimab을 투여받았습니다.
- 85.2%는 재태기간 37주 이상으로 태어났습니다.
- 신생아 및 영아의 40.0%는 5 kg 미만(2.5%는 2.5 kg 미만)이었습니다.
- 38.0%는 5 kg 미만(62%는 5 kg 이상)이었습니다.
- 연구에 참여한 신생아 및 영아의 월령은 48.6%는 생후 3개월 이하, 23.7%는 생후 3-6개월 사이, 27.7%는 생후 6개월 초과였습니다.
- 베이포투스™는 표준치료* 대비 RSV로 유발된 하기도 감염으로 인한 입원 치료의 상대적 위험을 유의하게 감소시켰습니다.
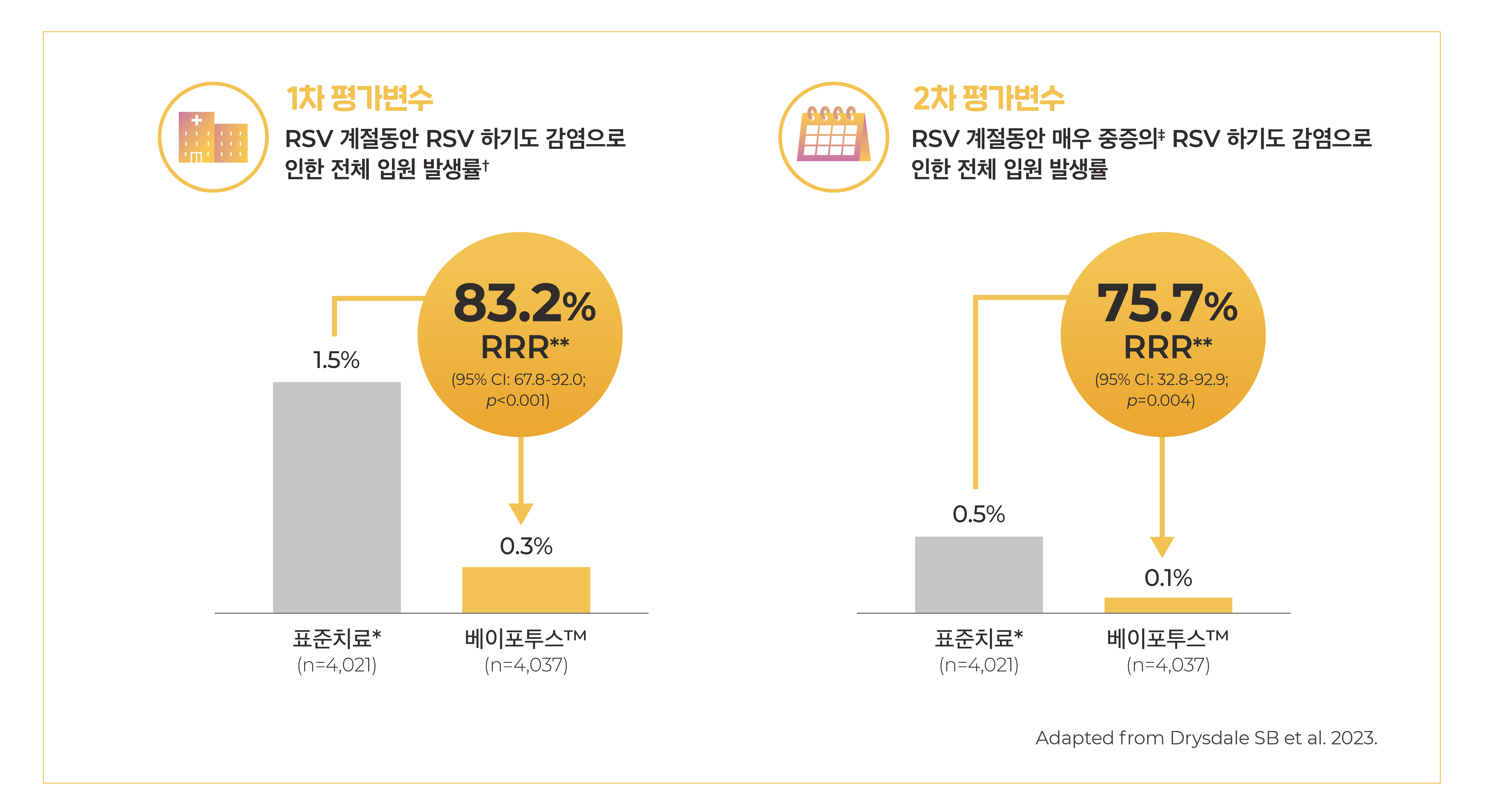
- 베이포투스™를 투여받은 신생아 및 영아 중 0.3%만이 RSV로 유발된 하기도 감염으로 입원 치료를 받았습니다.
- 베이포투스™군: 0.3%(n=11/4,037)(1000명당 <1건/월)
- 표준치료*군: 1.5%(n=60/4,021)(1000명당 6건/월)
[estimated efficacy, 83.2% (95% CI, 67.8 to 92.0; P<0.001)] - 베이포투스™를 투여받은 신생아 및 영아 중 0.1%만이 RSV로 유발된 매우 심각한 하기도 감염으로 입원 치료를 받았습니다.
- 베이포투스™군 0.1%(n=5/4,037)(1000명당 <1건/월)
- 표준치료*군: 0.5%(n=19/4,021)(1000명당 2건/월)
[estimated efficacy, 75.7% (95% CI, 32.8~92.9; P=0.004)] - 베이포투스™는 다양한 국가에서 RSV로 유발된 하기도 감염으로 인한 입원 치료의 상대적 위험을 감소시켰습니다.
- 프랑스: 89.6% (adjusted 95% CI, 58.8 to 98.7; multiplicity-adjusted P<0.001)
- 독일: 74.2% (adjusted 95% CI, 27.9 to 92.5; multiplicity-adjusted P=0.006)
- 영국: 83.4% (adjusted 95% CI, 34.3 to 97.6; multiplicity-adjusted P=0.003) - 베이포투스™는 RSV 계절동안 모든 원인으로 인한 하기도 감염과 관련된 입원 건수를 감소시켰습니다.
- 베이포투스™에 대한 이상사례의 종류와 빈도는 위약과 유사했습니다.
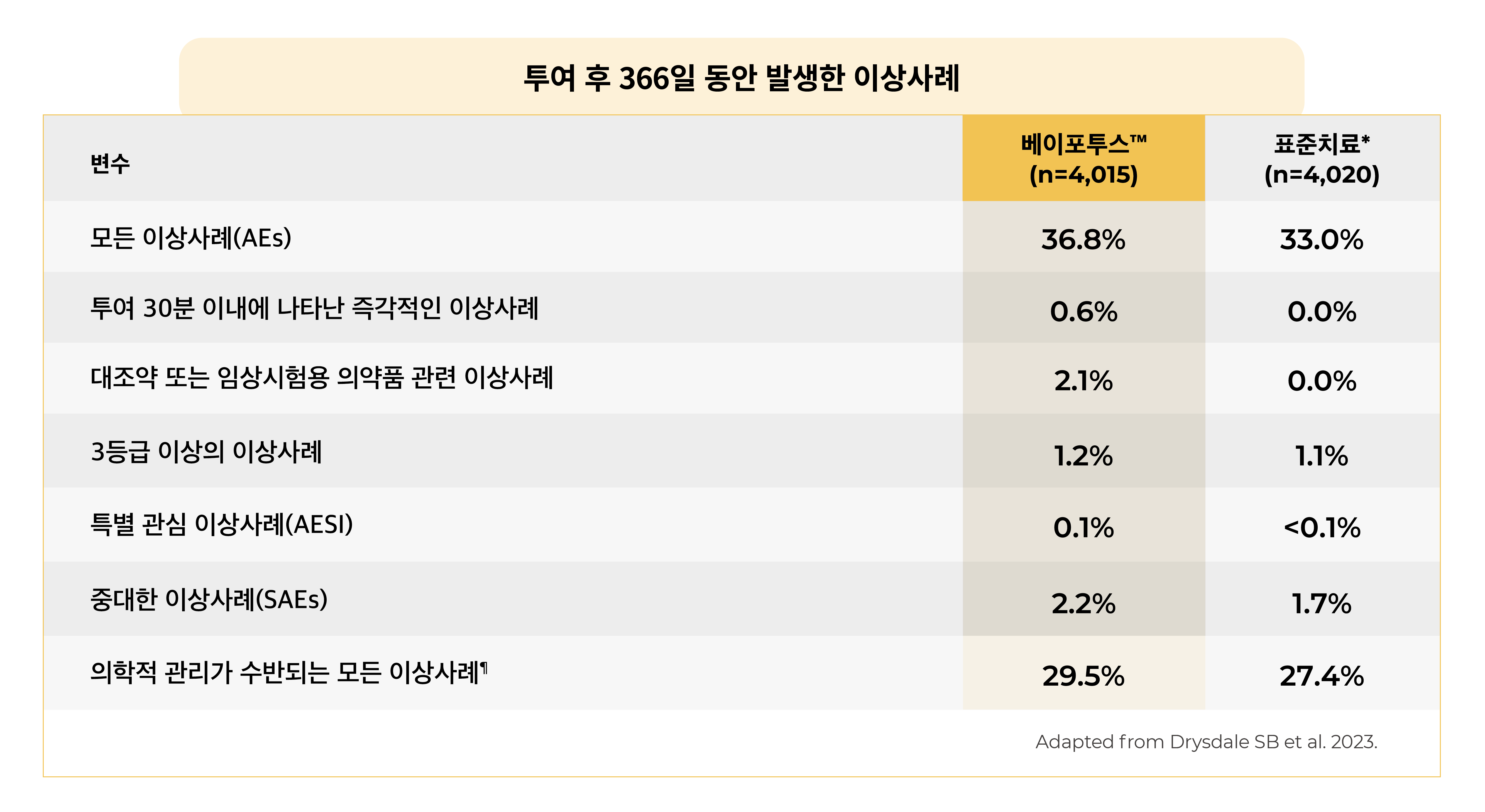
- 베이포투스™군 2.1%(n=86/4,037)에서 치료 관련 부작용이 발생했습니다.
두 치료군 모두에서 대부분의 이상사례는 1등급 또는 2등급의 중등도였습니다. - 4명의 신생아 및 영아에서 특별 관심 대상의 이상사례(AESI)가 보고되었습니다.
- 베이포투스™군: 약물 반응으로 인한 발열 및 발진 1명, 반점상구진성 발진 1명, 알레르기성 피부염 1명
- 표준치료*군: 식품 알레르기 1명 - 베이포투스™ 투여 23일 후에 3등급 이상의 중대한 이상사례(infantile spasms [West syndrome]) 1건이 발생하였습니다. 이는 임상시험용 의약품과 관련된 이상사례로 간주되었으나, 해당 연구 규모의 연구에서 예측 가능한 발생 빈도였습니다.
Conclusion
- 실제 환경과 최대한 유사한 조건에서 RSV 계절 전 또는 RSV 계절 도중 베이포투스™의 투여는 신생아 및 영아의 RSV 관련 하기도 감염으로 인한 입원 치료의 위험을 감소시켰습니다.
*표준치료: 대증치료라고도 하며, 수액공급, 해열제 등 보존적인 치료, 고위험요소를 가지고 있을 경우 평가에 따라 산소치료 또는 입원치료를 할 수 있음.2
†RSV 시즌 동안 프랑스, 독일, 영국의 관행에 따른 검사에서 RSV 양성이 확인되어, 치료 의사의 결정에 따라 병원에 입원한 경우.
‡ 입원 중 언제든지 산소포화도가 90% 미만이고(WHO에 정의된 사례에 따름 ), 산소 치료가 필요한 RSV 관련 하부 호흡기 감염으로 인한 입원.
** The 2-sided 95% CI for the efficacy is calculated by an exact method assuming a binomial distribution of the number of RSV LRTI hospitalizations in the nirsevimab group conditional on the total number in both groups (described by Breslow and Day) accounting for the follow-up time post dosing/randomization.
¶ Medically attended events are listed according to system organ classes and preferred terms in the Medical Dictionary for Regulatory Activities, version 25.0, and include those that occurred in at least 1% of infants in at least one of the two trial groups.
AESI, adverse event of special interest; CI, confidence interval; D, day; LRTI, lower respiratory tract infection; MAAE, 23 medically attended adverse event; RSV, respiratory syncytial virus; SAE, serious adverse event; V, visit.
1. Drysdale SB et al. N Eng J Med 2023; 389: 2425–2435. 2. 대구광역시 감염병 관리 지원단. 2023년 호흡기세포융합 바이러스(RSV) 감염증 역학조사 안내. 3. Modjarrad K et al. Vaccine. 2016;34:190–197.
제품을 처방하기 전에 반드시 국내 허가사항을 확인하시기 바랍니다.



