면역 저하 또는 결핍이 있는 신생아 및 영아에서 Nirsevimab의 안전성 및 약동학
Safety and Pharmacokinetics of Nirsevimab in Immunocompromised Children
Domachowske J, Hamrén UW, Banu I, Baronio R, Basavaraju B, Koen A, Leach A, Mankad VS, Pannaraj PS, Soler-Palacin P, Takas T, Mori M, Villafana T, for the MUSIC Study Group.
.webp/jcr:content/10.%20DRIVE-THRU%20ARTICLE_MO.jpg)
면역 저하 또는 결핍이 있는 신생아 및 영아에서 Nirsevimab의 안전성 및 약동학
Methods
- Phase II, 공개 라벨, 무대조군, 단회 투여 임상 연구
- 심각한 RSV 질환에 취약할 수 있는 면역 저하 상태인 신생아 및 영아의 두 번째 RSV 계절까지 베이포투스™의 안전성, 약동학(PK), 항-약물 항체(ADA)의 반응을 12개월간 평가하였습니다.
- 생후 첫 RSV 계절 또는 두 번째 RSV 계절에 진입하는 1개 이상의 면역 저하 상태가 있는 24개월 이하의 영아(재태 기간 29주 이상)들이 포함되었습니다.
- 면역 저하 상태: 원발성 면역 결핍, HIV 감염, 장기 또는 골수 이식의 병력, 면역 억제 화학 요법/전신 고용량 코르티코스테로이드 요법/기타 면역 억제 요법을 받고 있는 경우 - 베이포투스™는 RSV 계절마다의 단회 근육 내 투여되었습니다.
- 첫 번째 RSV 계절: 5 kg 미만인 경우 50 mg, 5 kg 이상인 경우 100 mg
- 두 번째 RSV 계절: 모든 영아 200 mg 단회 근육 내 투여
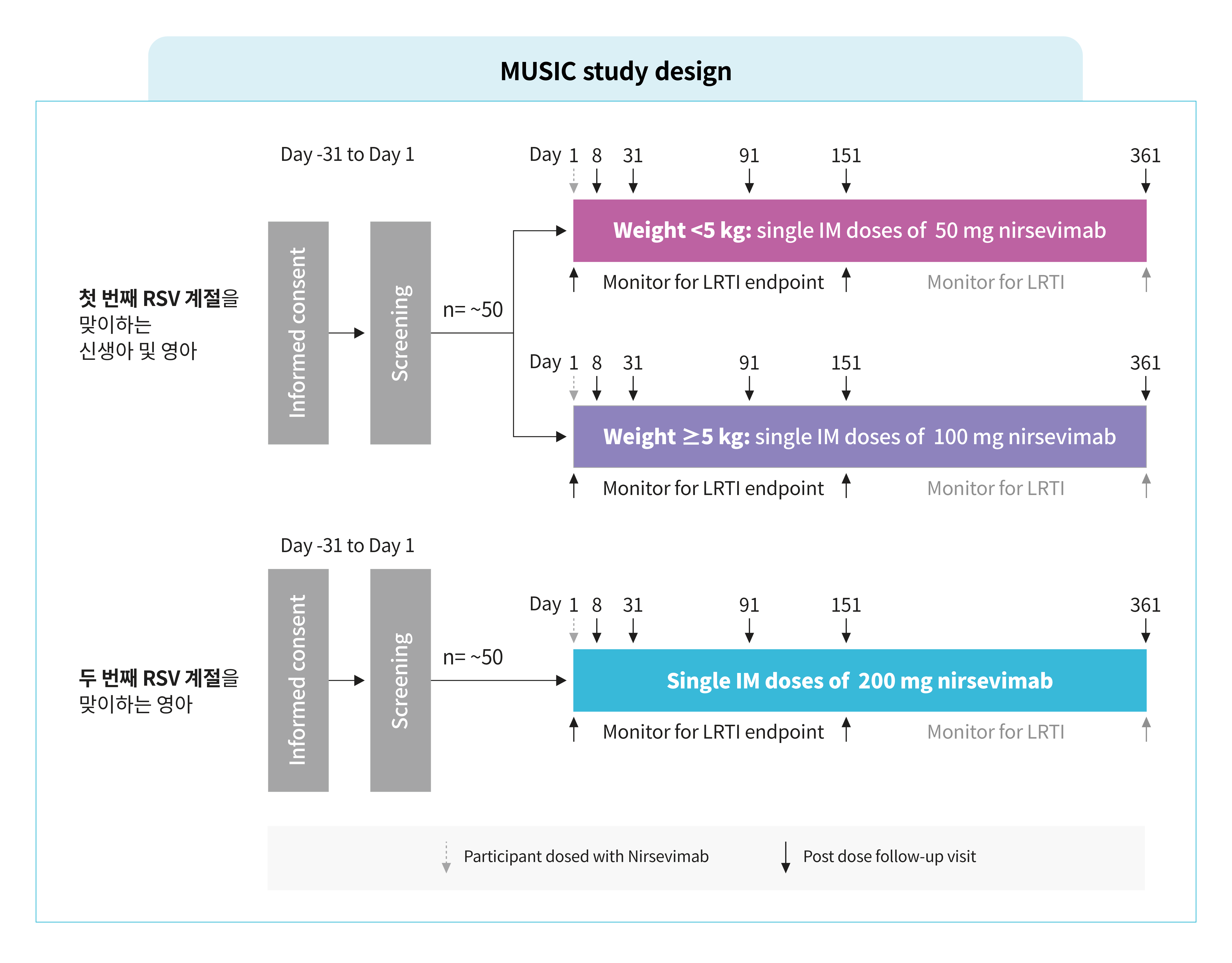
- 1차 평가변수: 투여 후 360일 동안 안전성 및 내약성 :
안전성은 이상사례(AE), 중대한 이상사례(SAE), 특별 관심 대상의 이상사례(AESI), 면역 복합 질환, 새롭게 발병된 만성 질환(NOCDs)을 포함하여 360일 동안 안전성 및 내약성을 평가했습니다. - 2차 평가변수: 투여 후 360일 동안의 혈청 농도(PK) 및 항-약물 항체(ADAs) 반응, 투여 후 150일 동안 RT-PCR로 확인된 의학적 관리가 수반되는 RSV 하기도 감염(MA RSV LRTI) 발생률* 및 MA RSV LRTI로 인한 입원
- 특별 관심 대상의 이상사례(AESI)에는 아나필락시스를 포함한 즉시성 과민반응, 면역 복합체 질환(예; 혈관염, 심내막염, 신경염, 사구체신염, 혈청병, 관절통) 또는 혈소판 감소증 및 새롭게 발병된 만성 질환(NOCDs)이 포함되어 있습니다.
-
혈청 샘플은 투여 전, 8일차(일본만 해당), 31일차, 151일차, 361일차, 그리고 참가자가 호흡기 질환으로 입원해야 할 때마다 수집했습니다.
* To meet the protocol-defifined endpoint of MA LRTI subjects must have had a positive RT-PCR test for RSV, one physical exam fifinding of rhonchi, rales, crackles, or wheeze, AND at least one indicator of clinical severity.
Results
참가자 기저 특징
- 총 8개국에서 106명의 참가자 중 100명이 등록되었습니다.
- 85.2%는 재태기간 37주 이상으로 태어났습니다.
- 투여 시 평균 연령은 13.0개월이었고, 출생 시 평균 제태 기간은 39주였습니다(median, range; 31~42주).
- 첫 번째 RSV 계절을 맞이하는 참가자는 46%(n=46)였고, 두 번째 RSV 계절을 맞이하는 참가자는 54%(n=54)였습니다.
- 면역 저하 또는 결핍 질환에는 원발성 면역 결핍(n=33), 고용량 전신 코르티코스테로이드 요법(n=29), 면역 억제 항암 요법(n=20), 장기 또는 골수 이식의 병력(n=16), 기타 면역 억제 요법(n=15) 및 HIV 감염(n=8)이 포함되었습니다.
- 베이포투스™는 면역 저하 또는 결핍이 있는 24개월 이하의 신생아 및 영아에서 투여 후 360일 동안 안전성 문제가 발생하지 않았으며, 우수한 내약성을 보였습니다.
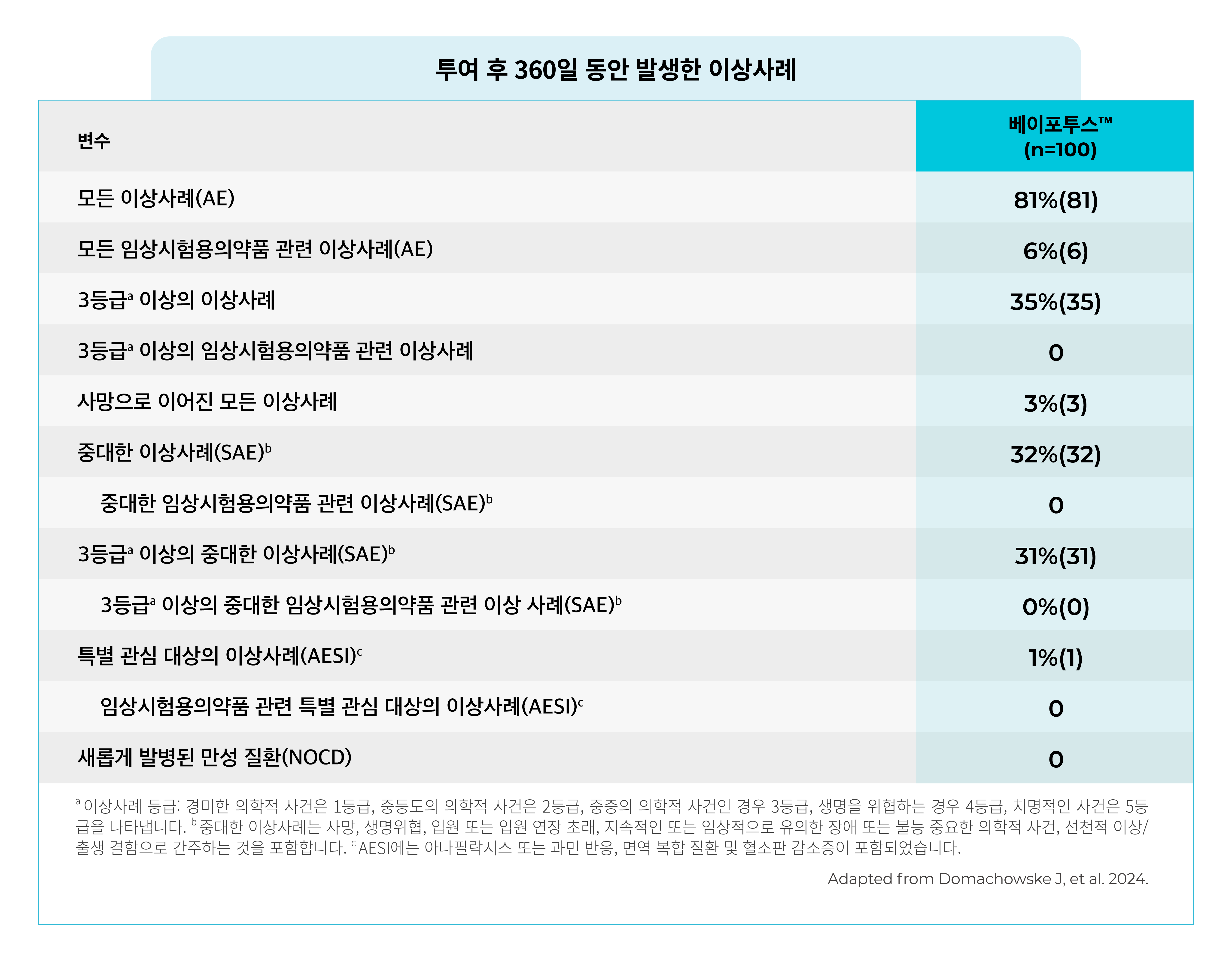
- 6%(n=6)에서 치료 관련 이상사례가 발생했습니다.
- 모든 이상사례는 1등급 또는 2등급의 중등도였습니다. - 가장 흔한 이상사례는 발열(13명), 상기도 감염(9명), 구토(8명)였습니다.
- 치료 관련 SAE 또는 NOCD는 관찰되지 않았습니다.
- 5명의 참가자에서 6건의 AESI가 보고되었으며, 임상시험용의약품과 관련된 경우는 홍반 1건으로 간주되었습니다.
- 음식 알레르기(2명), 조영제 알레르기(1명), 두드러기(2명), 홍반(1명) - 사망으로 이어진 모든 이상 사례는 3건이었으며, 이러한 의학적 사건은 임상시험용의약품과 관련이 없는 것으로 간주되었습니다.
- Non-RSV LRTI(RSV 검사 결과는 음성, 그람 양성 구균 관찰), 패혈성 쇼크(Klebsiella pneumoniae 분리), 종양 출혈 의심 - 항-약물 항체(ADAs) 반응은 11%에서 반응이 나타났으며, 약동학(PK)에 미치는 영향은 미미하였고 안전성 프로파일에 영향을 미치지 않았습니다.
- 면역 저하 또는 결핍이 있는 신생아 및 영아에서 베이포투스™의 평균 혈청 농도는 건강한 미숙아 및 만삭아 대상으로 진행된 3상 MELODY 임상 연구에서 관찰된 것과 유사하게 나타났습니다.
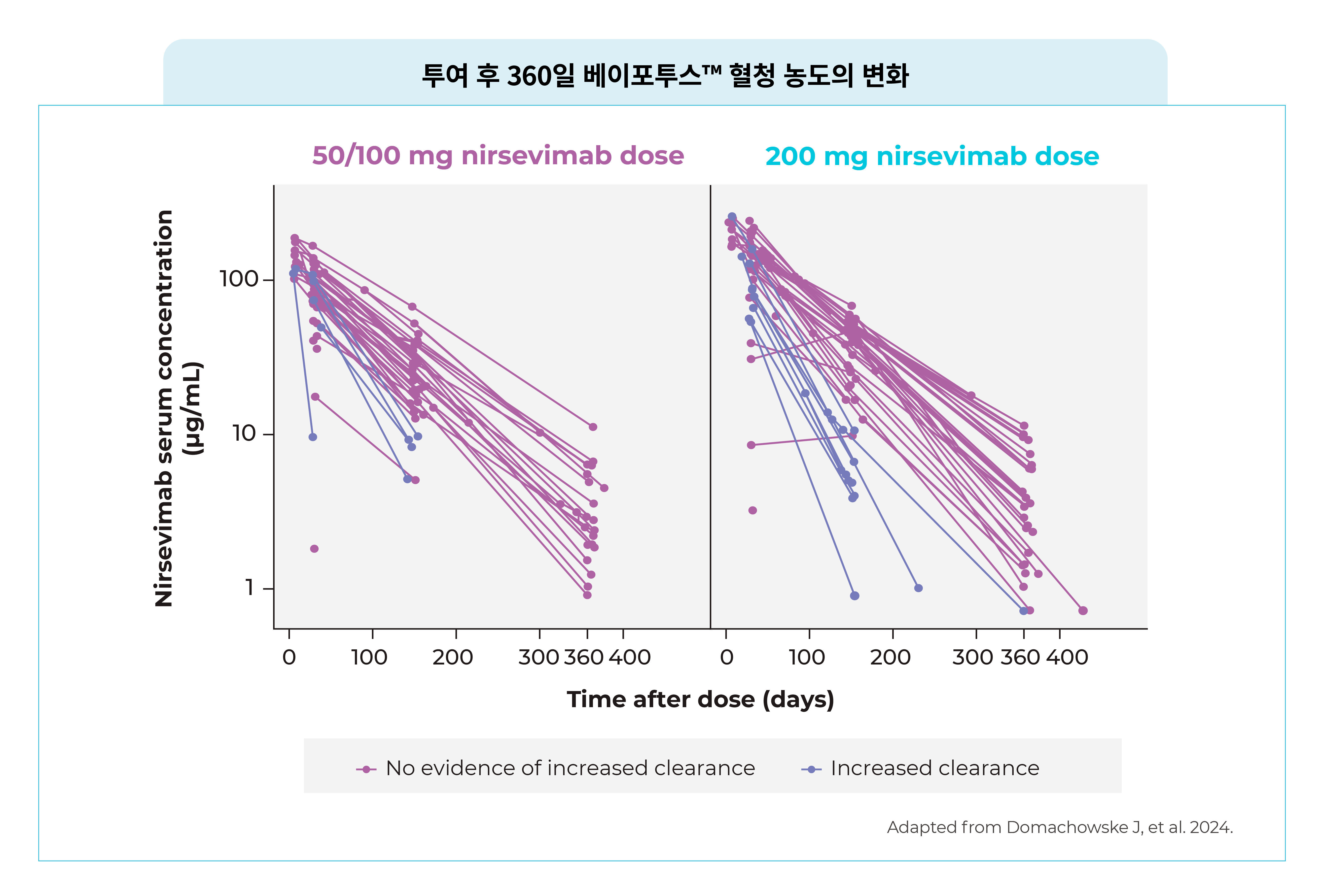
- 단백질 손실과 관련된 질환이 있는 일부 참가자(14명)에게서 베이포투스™ 청소율이 증가 하였으나, 151일째까지 MA RSV LRTI 발생은 나타나지 않았습니다.
: 청소율이 증가된 경우에도 베이포투스™의 중화 항체 농도는 palivizumab보다 높게 나타났습니다. [Nirsevimab ≥1000 IU/mL vs. Palivizumab 705 IU/mL(혈청 농도 100 μg/mL)] - 베이포투스™ 투여 151일차까지 의학적 관리가 수반되는 RSV 하기도 감염(MA RSV LRTI) 사례는 나타나지 않았습니다.
Conclusion
- 베이포투스™(Nirsevimab)는 24개월 이하의 면역 저하 또는 결핍이 있는 신생아 및 영아에서투여 후 360일 동안 안전성 문제가 발생하지 않았고, 151일차까지 효능을 뒷받침하는 혈청 농도를 유지했습니다.
ADA, antidrug antibodies; AE, adverse event; AESI, adverse events of special interest; HIV, human immunodeficiency virus; IM, intramuscular; LRTI, lower respiratory tract infection; NOCD, new-onset chronic disease; MA, medical attended; PK, pharmacokinetics; RSV, respiratory syncytial virus; SAE, serious adverse event.
1. Domachowske J, et al. Pediatrics. 2024 Oct 1;154(4):e2024066508. 2. Hammitt LL, et al. N Engl J Med. 2022 Mar 3;386(9):837-846.
제품을 처방하기 전에 반드시 국내 허가사항을 확인하시기 바랍니다.



