Le pouvoir de réduire le chaos lié au VRS1-4

Tous les nourrissons sont exposés au risque de contracter une infection des voies respiratoires inférieures (IVRI) due au virus respiratoire syncytial (VRS)*5-11, mais nous ne pouvons pas prédire qui sera affecté.12
L'IVRI due au VRS est une principale cause d’hospitalisation chez les nourrissons, indépendamment de leur état de santé, de leur âge gestationnel à la naissance ou du mois de naissance.**,5-11,13-16
Beyfortus® est remboursé pour les bébés dans le cadre de la prévention du VRS¤
Consultez les formulaires de demande de remboursement pour les bébés:
Caractéristiques des bébés hospitalisés pour VRS
|
|
|
Beyfortus® a le pouvoir de réduire le chaos de la saison du VRS
Beyfortus® réduit le risque des infections des voies respiratoires inférieures (IVRI) dues au VRS nécessitant une prise en charge médicale (PCM), y compris l'hospitalisation, chez les nourrissons.1
Beyfortus® est la première et unique immunisation contre le VRS conçue pour tous les nourrissons, destinée à les protéger contre les IVRI causées par le VRS.1
Beyfortus® est destiné à protéger contre les infections des voies respiratoires inférieures (IVRI) causées par le virus respiratoire syncytial (VRS) au cours de la première saison du VRS chez les nourrissons, grâce à une seule administration d’anticorps.1
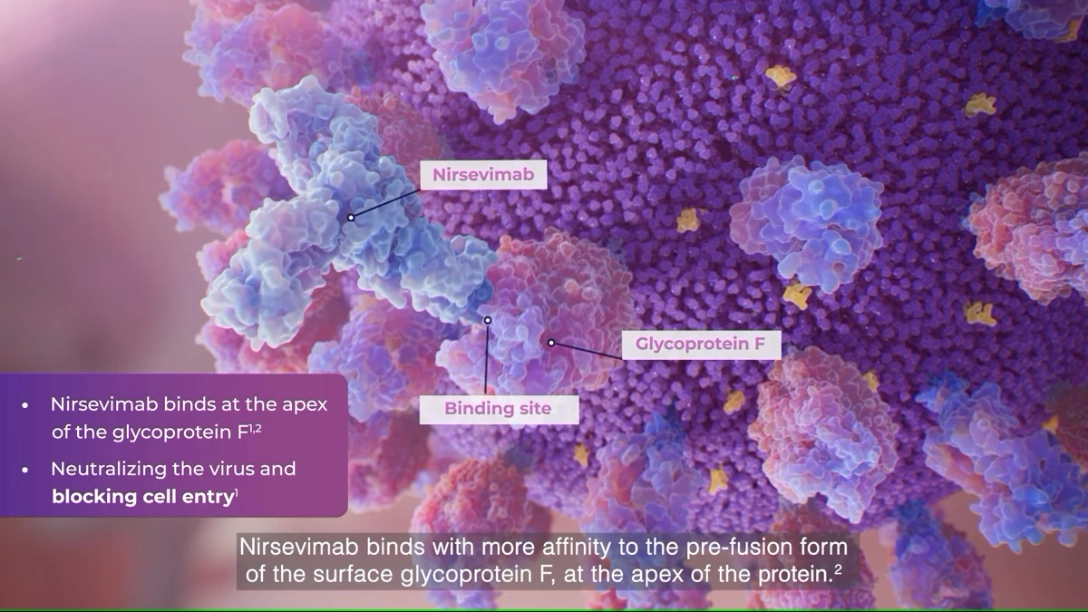
Beyfortus® est un anticorps direct à action prolongée1
|
|
|
|
Regardez la vidéo pour en savoir plus sur le mode d'action du Beyfortus®
Le programme de développement du Beyfortus® a été mené à travers une vaste population de nourissons1-4,18
Cela incluait des nourissons en bonne santé nés à terme, des nourissons prématurés et ceux atteints de cardiopathies congénitales et de maladies pulmonaires chroniques de la prématurité.1-4,18
|
|
|
|
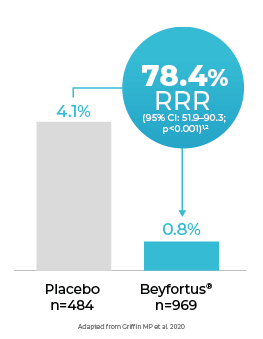
Beyfortus® réduit le risque d'hospitalisations d'IVRI dues au VRS
Ci-dessous, vous trouverez un résumé de la réduction du risque relatif (RRR) des hospitalisations pour les IVRI causées par le VRS jusqu'à 150 jours après l'administration dans les études de phase 2b et MELODY, et pendant la saison du VRS pour l'étude HARMONIE.
Profil de sécurité
La sécurité a été étudiée dans une large population, comprenant des bébés prématurés ou nés à terme et en bonne santé, et ceux présentant un risque plus élevé d’infections des voies respiratoires inférieures (IVRI) dues au VRS. Les types et la fréquence des effets indésirables (EI) avec Beyfortus® étaient similaires à ceux du placebo dans les études de phase 2b et de phase 3.2-4, 19
L’effet indésirable le plus fréquent était les éruptions cutanées (0,7 %) survenues dans les 14 jours suivant l’administration. La majorité des cas étaient d’intensité légère à modérée. De plus, une pyrexie et des réactions au site d’injection ont été rapportées à un taux respectif de 0,5 % et 0,3 % dans les 7 jours suivant l’administration. Les réactions au site d’injection étaient non graves.1
Effets indésirables rapportés chez 2 966 nourrissons nés à terme et prématurés (âge gestationnel [AG] ≥ 29 semaines) ayant reçu Beyfortus® dans le cadre d'essais cliniques1
| Classe de systèmes d’organes | Terme préféré | Fréquence |
| Affections de la peau et du tissu sous-cutané | Éruptions cutanées | Peu fréquent |
| Troubles généraux et anomalies au site d’administration | Réaction au site d’injection | Peu fréquent |
| Pyrexie | Peu fréquent |
Adapté de Beyfortus® - Résumé des caractéristiques du produit BE (11/2023). La fréquence "Peu fréquent" est comprise entre ≥ 1/1 000 et < 1/100.
Dans l’étude sur les nourrissons présentant un risque plus élevé de contracter une forme grave du VRS, le profil de sécurité de Beyfortus® était similaire à celui du palivizumab et cohérent avec celui observé dans les études menées chez des nourrissons en bonne santé, nés à terme et prématurés (AG ≥ 29 semaines).‡,1,2
Consultez le RCP pour les mises en garde et les précautions d’emploi.‡
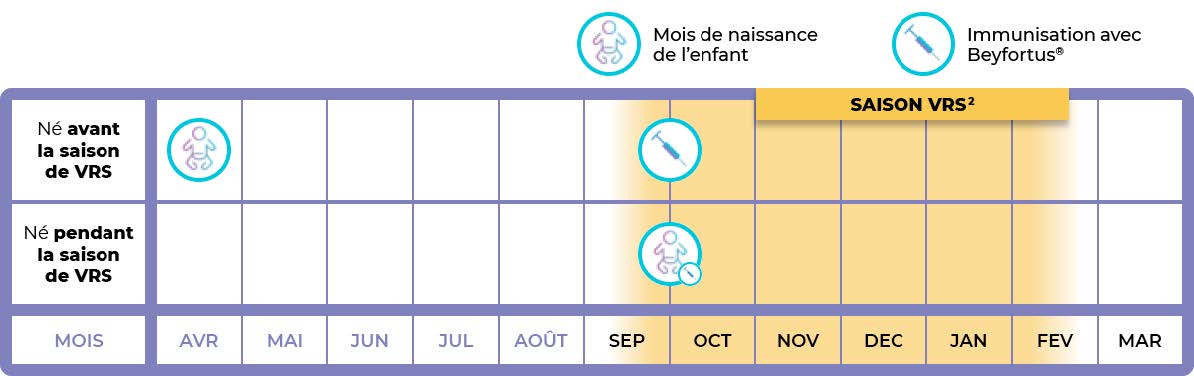
L’administration doit coïncider avec la première saison du VRS du nourrisson1 - la période où le risque d'infection des voies respiratoires inférieures (IVRI) est le plus élevé.20
Comment utiliser Beyfortus® ?
Beyfortus® est simple à mettre en œuvre dans les établissements de soins primaires et secondaires.
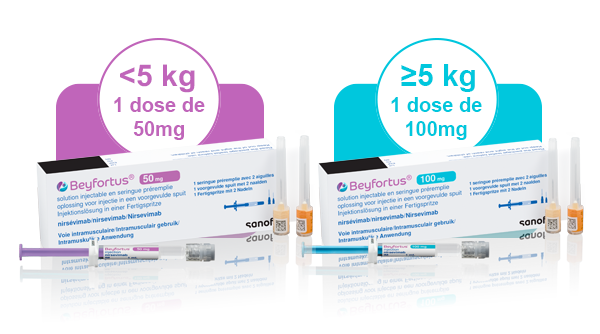
Beyfortus® est remboursé pour tout les nouveau-nés : à terme et pré-terme âgés de moins de 13 mois, pour la première saison de VRS pour les dosages suivants :
Une seule administration
Basée sur le poids du nourrisson au moment de l'injection avec Beyfortus®.****,1
Beyfortus® doit être administré par voie intramusculaire, de préférence dans la partie antérolatérale de la cuisse.*****,1
Pour les enfants qui demeurent vulnérables à une infection sévère par le VRS au cours de leur deuxième saison d’épidémie à VRS 200 mg est administrés en 2 injections de 100 mg sur des sites distincts.
Beyfortus® doit être administré de préférence avant la saison d’épidémie à VRS. La circulation du virus est généralement plus marquée en hiver (on parle de saison d’épidémie à VRS). Si votre enfant naît en hiver, Beyfortus devra être administré après la naissance.1
Considérations pratiques
* Pourcentage d'enfants nés en bonne santé et/ou à terme parmi les enfants hospitalisés en raison du VRS selon différentes analyses rétrospectives : France (2010-2018 ; chez les enfants <5 ans) : 87 % en bonne santé et 90 % à terme;5 Espagne (2004-2012 ; chez les nourrissons) : 98 % en bonne santé et à terme;6 Japon (janvier 2017-décembre 2018 ; chez les enfants ≤2 ans) : 90 % en bonne santé et à terme ;7 Allemagne (2015-2018 ; chez les nourrissons) : 90 % en bonne santé et 83 % à terme;8 Chine (2007-2015, chez les enfants âgés de 28 jours à 13 ans) : 88 % en bonne santé et à terme (âge médian de 1,4 an);9 Royaume-Uni (Écosse 2000-2011 ; chez les enfants ≤2 ans) : 93 % en bonne santé et 82 % à terme10 ; États-Unis (surveillance basée sur la population 2014-2015 ; chez les nourrissons ≤11 mois) : 72 % en bonne santé et à terme.11
** Selon des analyses rétrospectives menées en France (45 225 hospitalisations dues au VRS par saison entre 2010 et 2018)5 et aux États-Unis (243 834 bronchiolites dues au VRS, 38 064 pneumonies dues au VRS et 15 786 autres hospitalisations dues au VRS chez des nourrissons âgés de moins d'un an entre 1997 et 1999).13
*** Basé sur des données cliniques et pharmacocinétiques.1
**** La dose recommandée est une dose unique de 50 mg administrée par voie intramusculaire pour les nourrissons dont le poids corporel est <5 kg et une dose unique de 100 mg administrée par voie intramusculaire pour les nourrissons dont le poids corporel est ≥5 kg.1 Veuillez consulter le Résumé des caractéristiques du produit pour obtenir des informations complètes sur la posologie et l'administration.
***** Le muscle fessier ne doit pas être utilisé systématiquement comme site d'injection en raison du risque de lésion du nerf sciatique.1
+ Selon une étude anglaise où 51 % (n=10 328/20 359) des hospitalisations dues au VRS sont survenues chez des nourrissons nés avant la saison (avril à octobre)15 ; une étude espagnole où 54 % (n=340/631) des nourrissons hospitalisés en raison du VRS étaient nés avant la saison (avril à octobre)14 ; et une étude française où 47 % (n=85 292/181 758) des nourrissons hospitalisés en raison du VRS étaient nés avant la saison (avril à octobre).5
‡ La sécurité a été évaluée dans l'étude MEDLEY chez 918 nourrissons présentant un risque plus élevé de maladie grave due au VRS, dont 196 grands prématurés (AG <29 semaines) et 306 nourrissons atteints d'une maladie pulmonaire chronique de la prématurité ou d'une "cardiopathie congénitale hémodynamiquement significative entrant dans leur première saison de VRS", qui ont reçu du nirsévimab (614) ou du palivizumab (304).1
¤ Consultez le site web de l'INAMI pour plus d’info sur les modalités de remboursement de Beyfortus®: https://webappsa.riziv-inami.fgov.be/ssp/ProductSearch
Références
-
Résumé des Caractéristiques du Produit Beyfortus® - 04/2024
-
Griffin MP et al. N Engl J Med 2020; 383(5): 415-425
-
Domachowske J et al. N Engl J Med 2022; 386(9): 892-894
-
Hammitt LL et al. N Engl J Med 2022; 386(9): 837-846
-
Demont C et al. BMC Infect Dis 2021; 21(1): 730.
-
Sanchez-Luna M et al. Curr Med Res Opin 2016; 32(4): 693-698.
-
Kobayashi Y et al. Ped Intl 2021; 64(1): e 14957.
-
Yu Jet al. Emerg Infect Dis 2019; 25(6): 1127-1135.
-
Hartmann K et al. J Infect Dis 2022; 226(3): 386-395.
-
Arriola C et al. J Pediatric Infect Dis Soc 2020; 9(5): 587-595.
-
Thwaites R et al. Eur J Pediatr 2020; 179(5): 791-799.
-
Bianchini S et al. Microorganisms 2020; 8(12): 2048
-
Leader S and Kohlhase K. Pediatr Infect Dis J 2002; 21(7): 629-632.
-
Mira-Iglesias A et al. Influenza Other Respir Viruses 2022; 16(2): 328-339.
-
Reeves RM et al. J Infect 2019; 78(6): 468-475.
-
Gantenburg JR et al. J Infect Dis 2022; 226(Suppl 2): S164-S174.
-
Heinonen S et al. Immunol Allergy Clin North Am 2019; 39(3): 361-376.
-
Drysdale SB et al. N Eng J Med 2023; 389: 2425-2435 & Protocol.
-
Muller WJ et al. N Engl J Med 2023; 388(16): 1533-1534.
-
Esposito S et al. Front Immunol 2022; 13: 880368.