SFD 2024 : Flashback sur quelques séances marquantes
Diabète de type 1 : tous dans les starting blocks pour changer le cours de la maladie.
L'immunité au coeur des diabètes : un aspect central de la SFD 2024.
Focus sur la cellule beta / exploration de la pathogenèse du diabète.

DT1, tous dans les starting blocks pour changer le cours de la maladie
Après une mise en route énergisante par le prof. Chantal Mathieu, le prof. Roberto Mallone nous a présenté une analyse détaillée du dépistage précoce du diabète de type 1 (DT1) à travers l'évaluation des auto-anticorps (anti-insuline (IA), GAD65, IA2 et ZNT8) ainsi que l'utilisation du typage HLA pour évaluer le risque génétique. L'importance du nombre d'auto-anticorps dans la prédiction du risque fut soulignée, avec un seuil de 2 auto-anticorps considéré comme significatif1.
Le suivi des personnes porteuses d’auto-anticorps positifs fut également abordé, soulignant l'importance des recommandations internationales pour orienter la pratique clinique2. Les différents stades du DT1 présymptomatique furent définis, avec des recommandations de suivi intensif en fonction du nombre d'auto-anticorps, de la présence de dysglycémie et de l'âge de la personne. Outre la réduction de l’incidence de l’acido-cétose au diagnostic3 et l’opportunité d’éducation des personnes concernées, l'objectif principal du dépistage précoce est de préserver la fonction des cellules bêta pancréatiques, ce qui peut être réalisé par l'administration précoce de traitements immunomodulateurs4-6.
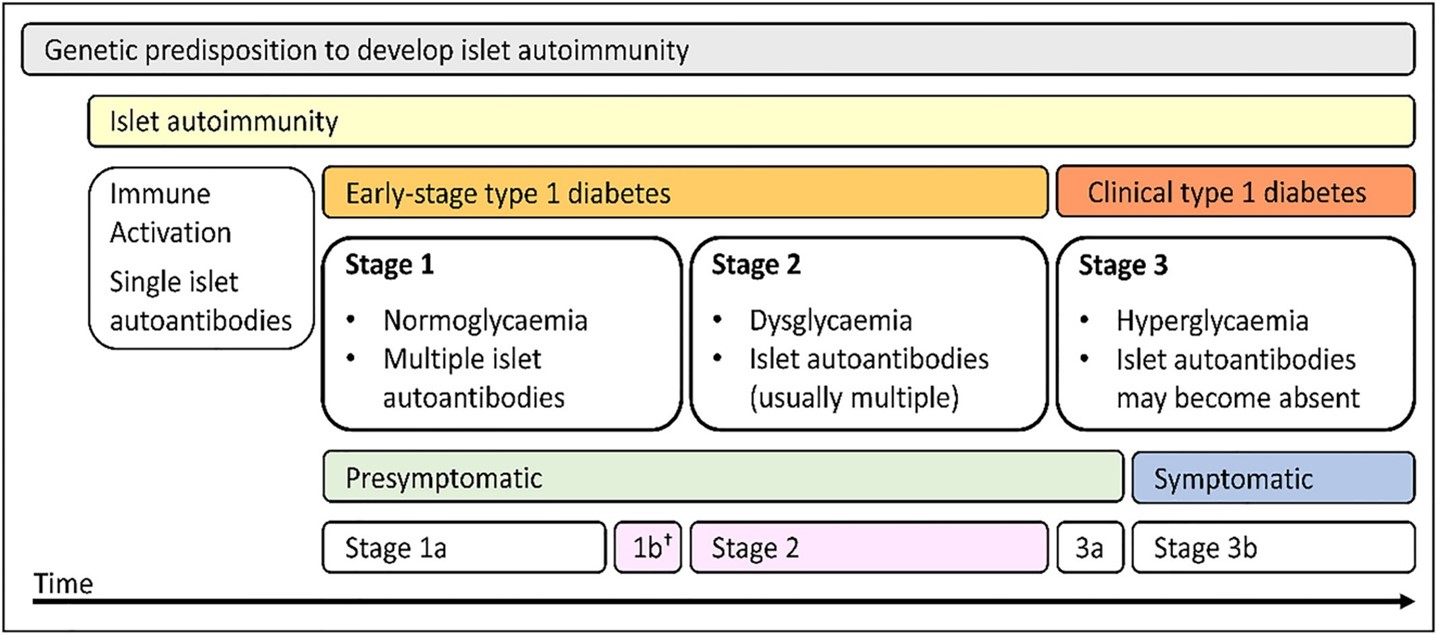
From: Hendriks AEJ, Marcovecchio ML, Besser REJ, et al. Clinical care advice for monitoring of islet autoantibody positive individuals with presymptomatic type 1 diabetes. Diabetes Metab Res Rev. 2024;40(2):e3777. doi:10.1002/dmrr.3777.
A ce propos, le Prof. Jacques Beltrand a ensuite présenté les avancées dans le traitement du diabète de type 1 au cours des 100 dernières années, mettant en lumière les progrès récents qui visent à intervenir sur la maladie plutôt que de simplement substituer l'insuline. La découverte de la souris NOD a notamment permis de comprendre que le diabète de type 1 est une maladie auto-immune contre laquelle différentes approches thérapeutiques sont en cours de développement, notamment en ciblant les lymphocytes T et B ainsi que les cytokines pro-inflammatoires4. Des médicaments tels que les anticorps anti-CD3, le sérum antilymphocytaire, l'abatacept, le rituximab et l’anti-TNF-alpha ont été évalués dans des essais cliniques7. Les résultats montrent une préservation significative de la fonction résiduelle des cellules bêta dans certains cas, notamment chez les enfants6.
Le prof. Vambergue nous a ensuite présenté le centre de dépistage familial du prédiabète de type 1 à Lille, fondé en 1996 par Pierre Fontaine et des collègues pédiatres. Le suivi des personnes aux stades 1 et 2 permet de détecter la séroconversion et d'anticiper le développement du diabète. Sur 587 enfants inclus dans l'étude jusqu'en 2020, 16,4% ont présenté une séroconversion et 2,7% ont progressé jusqu’au stade 3. Les enfants diagnostiqués avaient en moyenne 10 ans et présentaient généralement plusieurs types d'anticorps8. Le suivi régulier a permis d'éviter les complications aiguës et d’améliorer le contrôle glycémique initial chez les enfants diagnostiqués. Des questions persistent cependant quant à l'impact psychosocial du dépistage et du suivi à long terme et des témoignages sont prévus pour apporter une perspective sur l'expérience vécue dans ce centre.
Pour terminer, Mme Aaron-Popelier, psychologue, a abordé la question des stratégies psychologiques et comportementales adoptées par les individus face au dépistage des maladies, en particulier le diabète de type 1 chez les enfants. Elle a souligné l'importance de comprendre les réactions émotionnelles et les mécanismes de défense qui peuvent influencer les décisions de dépistage.
Mme Aaron-Popelier encourage les soignants à adopter une approche empathique, basée sur l'écoute et la discussion ouverte avec les personnes souffrant de diabète de type 1 et leur entourage, afin de favoriser une décision éclairée et non coercitive.
L’immunité au cœur des diabètes… et de la SFD2024 !
Le diabète de type 2 présente une diversité clinique importante, ce qui a conduit à l'exploration de différentes méthodes de classification des patients diabétiques. En 2018, le « Leif group » a proposé une classification en cinq sous-groupes en incluant des variables telles que les auto-anticorps, l’HbA1c, l'âge, l'IMC et les indices HOMA9. Cependant, aucune classification n'a encore pris en compte le baromètre immunoflammatoire, malgré le rôle important de l'inflammation dans le diabète de type 2 (DT2). Afin d’explorer cette voie, environ 400 personnes vivant avec un DT2 ont été recrutés, et un clustering non supervisé a été réalisé en incluant des variables cliniques ainsi que le nombre de cellules immunitaires circulantes. Les résultats ont révélé quatre clusters distincts, chacun présentant des profils immunologiques et cliniques spécifiques. Ces données suggèrent la possibilité d'identifier un sous-groupe de patients inflammatoires, permettant ainsi de potentiellement prédire le développement de complications spécifiques. Par exemple, des travaux ont démontré une corrélation entre le nombre de monocytes circulants et le risque cardiovasculaire chez les personnes avec un DT2. Ces résultats soulignent l'importance de la caractérisation immunologique dans la gestion et le pronostic du diabète de type 210.
Cela résonne avec le discours du prof. Nathalie Esser qui nous a en effet brillamment présenté le projet INTERCEPT-T2D (Home - intercept-t2d) visant à établir le rôle du profil inflammatoire des personnes vivant avec le diabète de type 2 dans le développement précoce des lésions organiques caractéristiques de la maladie.
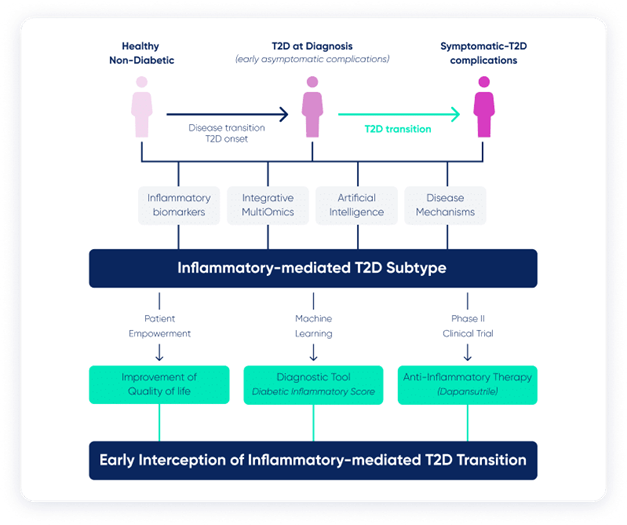
From : The project - intercept-t2d
Le programme comprend notamment un RCT (Dapan Dia Trial : Dapansutrile in Diabetes and Diabetes-Related Complications - Dapan-Dia - Full Text View - ClinicalTrials.gov) dont l’objectif est d’évaluer si l’inhibition de l’inflammasome NLRP3 par le Dapansutrile permet de mitiger le risque de complications micro- et macrovasculaires dans le diabète de type 2.
Focus sur la cellule beta : Plongeons dans la pathogenèse du diabète !
Le développement des immunothérapies pour prévenir la progression du diabète de type 1 est une avancée prometteuse. Cependant, l'augmentation de l'incidence de cette maladie suggère un rôle majeur des facteurs environnementaux. Des recherches récentes établissent un lien entre les infections antérovirales du groupe B et le diabète de type 1.
Cependant, l'impact direct du virus sur les cellules bêta pancréatiques reste à déterminer. Dans ce contexte, Clémentine Halliez nous a présenté les résultats d’une étude suggérant un effet cytopathique direct du Coxsackievirus B (CVB) sur les cellules bêta, indépendamment de l'activité des lymphocytes T. De plus, on observe une transmission intercellulaire du virus entre les cellules bêta via des phylopodes. Par conséquent, le développement d'un vaccin contre le CVB pourrait être une stratégie prometteuse pour prévenir le diabète de type 111.
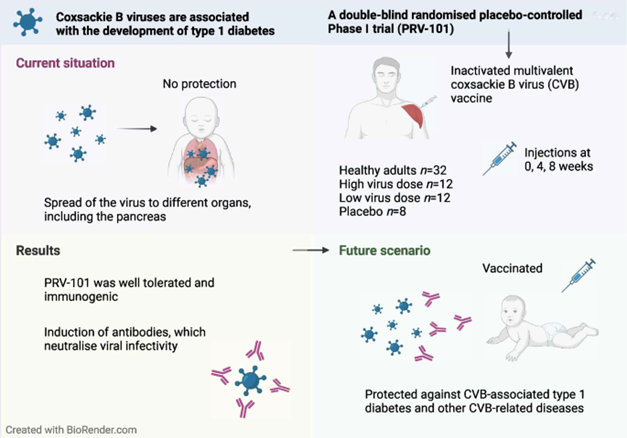
From : Hyöty H, Kääriäinen S, Laiho JE, et al. Safety, tolerability and immunogenicity of PRV-101, a multivalent vaccine targeting coxsackie B viruses (CVBs) associated with type 1 diabetes: a double-blind randomised placebo-controlled Phase I trial. Diabetologia. 2024;67(5):811-821. doi:10.1007/s00125-024-06092-w
Les dernières études mettant en lumière l'importance cruciale des ARN non codants, et en particulier des ARN circulaires, dans la régulation de la fonction des cellules bêta pancréatiques, particulièrement dans le contexte du diabète, ont également été présentées. Ces découvertes révolutionnaires ouvrent la voie à de nouvelles thérapies ciblées pour traiter le diabète de type 112.
De plus, des recherches approfondies ont été menées sur les fragments d'ARN de transfert et leur implication dans la maturation postnatale des cellules bêta pancréatiques, avec un accent particulier sur le diabète de type 1. Ces travaux révèlent un lien direct entre le système immunitaire et les cellules bêta pancréatiques, offrant ainsi de nouvelles perspectives pour mieux comprendre et traiter cette maladie complexe13.
L’équipe du prof. Miriam Cnop, quant à elle, a exploré le stress du réticulum endoplasmique et ses liens avec le diabète. Ils ont identifié des voies de signalisation clés, comme la voie PERK-NRF2, ouvrant ainsi de nouvelles opportunités pour le développement de thérapies innovantes14.
Enfin, une étude novatrice sur les interactions entre les cellules Alpha et Delta et leur impact sur les cellules bêta apporte de nouvelles perspectives sur la manière dont nous pouvons mieux comprendre et traiter les troubles métaboliques, ouvrant ainsi la voie à des thérapies plus personnalisées15.
Références
-
Insel RA, Dunne JL, Atkinson MA, et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 2015;38(10):1964-1974. doi:10.2337/dc15-1419
-
Hendriks AEJ, Marcovecchio ML, Besser REJ, et al. Clinical care advice for monitoring of islet autoantibody positive individuals with presymptomatic type 1 diabetes. Diabetes Metab Res Rev. 2024;40(2):e3777. doi:10.1002/dmrr.3777
-
Hummel S, Carl J, Friedl N, et al. Children diagnosed with presymptomatic type 1 diabetes through public health screening have milder diabetes at clinical manifestation. Diabetologia. 2023;66(9):1633-1642. doi:10.1007/s00125-023-05953-0
-
Bluestone JA, Buckner JH, Herold KC. Immunotherapy: Building a bridge to a cure for type 1 diabetes. Science. 2021;373(6554):510-516. doi:10.1126/science.abh1654
-
Herold KC, Bundy BN, Long SA, et al. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes [published correction appears in N Engl J Med. 2020 Feb 6;382(6):586]. N Engl J Med. 2019;381(7):603-613. doi:10.1056/NEJMoa1902226
-
Ramos EL, Dayan CM, Chatenoud L, et al. Teplizumab and β-Cell Function in Newly Diagnosed Type 1 Diabetes. N Engl J Med. 2023;389(23):2151-2161. doi:10.1056/NEJMoa2308743
-
Taylor PN, Collins KS, Lam A, et al. C-peptide and metabolic outcomes in trials of disease modifying therapy in new-onset type 1 diabetes: an individual participant meta-analysis [published correction appears in Lancet Diabetes Endocrinol. 2024 Feb;12(2):e12]. Lancet Diabetes Endocrinol. 2023;11(12):915-925. doi:10.1016/S2213-8587(23)00267-X
-
Ahlqvist E, Storm P, Käräjämäki A, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018;6(5):361-369. doi:10.1016/S2213-8587(18)30051-2
-
Julla JB, Girard D, Diedisheim M, et al. Blood Monocyte Phenotype Is A Marker of Cardiovascular Risk in Type 2 Diabetes. Circ Res. 2024;134(2):189-202. doi:10.1161/CIRCRESAHA.123.322757
-
Hyöty H, Kääriäinen S, Laiho JE, et al. Safety, tolerability and immunogenicity of PRV-101, a multivalent vaccine targeting coxsackie B viruses (CVBs) associated with type 1 diabetes: a double-blind randomised placebo-controlled Phase I trial. Diabetologia. 2024;67(5):811-821. doi:10.1007/s00125-024-06092-w
-
Stoll L, Rodríguez-Trejo A, Guay C, et al. A circular RNA generated from an intron of the insulin gene controls insulin secretion. Nat Commun. 2020;11(1):5611. Published 2020 Nov 5. doi:10.1038/s41467-020-19381-w
-
Bayazit MB, Jacovetti C, Cosentino C, et al. Small RNAs derived from tRNA fragmentation regulate the functional maturation of neonatal β cells. Cell Rep. 2022;40(2):111069. doi:10.1016/j.celrep.2022.111069
-
Eizirik DL, Pasquali L, Cnop M. Pancreatic β-cells in type 1 and type 2 diabetes mellitus: different pathways to failure. Nat Rev Endocrinol. 2020;16(7):349-362. doi:10.1038/s41574-020-0355-7Jennings RE, Scharfmann R, Staels W. Transcription factors that shape the mammalian pancreas. Diabetologia. 2020;63(10):1974-1980. doi:10.1007/s00125-020-05161-0

