SFD 2024 Flashback naar enkele belangrijk sessies
T1D, allemaal in de startblokken om het verloop van de ziekte te veranderen.
Immuniteit in het hart van diabetes... en SFD2024!
Focus op de bètacel: Laten we eens kijken naar de pathogenese van diabetes!

T1D, allemaal in de startblokken om het verloop van de ziekte te veranderen
Na een energieke opstart door Prof. Chantal Mathieu, presenteerde Prof. Roberto Mallone ons een gedetailleerde analyse van de vroege detectie van diabetes type 1 (T1D) door de evaluatie van auto-antilichamen (anti-insuline (AI), GAD65, IA2 en ZNT8) en het gebruik van HLA-typering om genetisch risico te beoordelen. Het belang van het aantal auto-antilichamen bij de voorspelling van het risico werd benadrukt, waarbij een drempel van 2 auto-antilichamen als significant werd beschouwd1.
De follow-up van mensen met positieve auto-antilichamen werd ook besproken, waarbij het belang van internationale aanbevelingen als leidraad voor de klinische praktijk werd benadrukt2. De verschillende stadia van presymptomatische T1D werden gedefinieerd, met aanbevelingen voor intensieve follow-up op basis van het aantal auto-antilichamen, de aanwezigheid van dysglykemie en de leeftijd van de persoon. Naast het verminderen van de incidentie van ketoacidose bij diagnose3 en het bieden van de mogelijkheid voor voorlichting aan de getroffenen, is het belangrijkste doel van vroege opsporing het behoud van de bètacelfunctie van de alvleesklier, wat kan worden bereikt door vroege toediening van immunomodulerende behandelingen4-6.
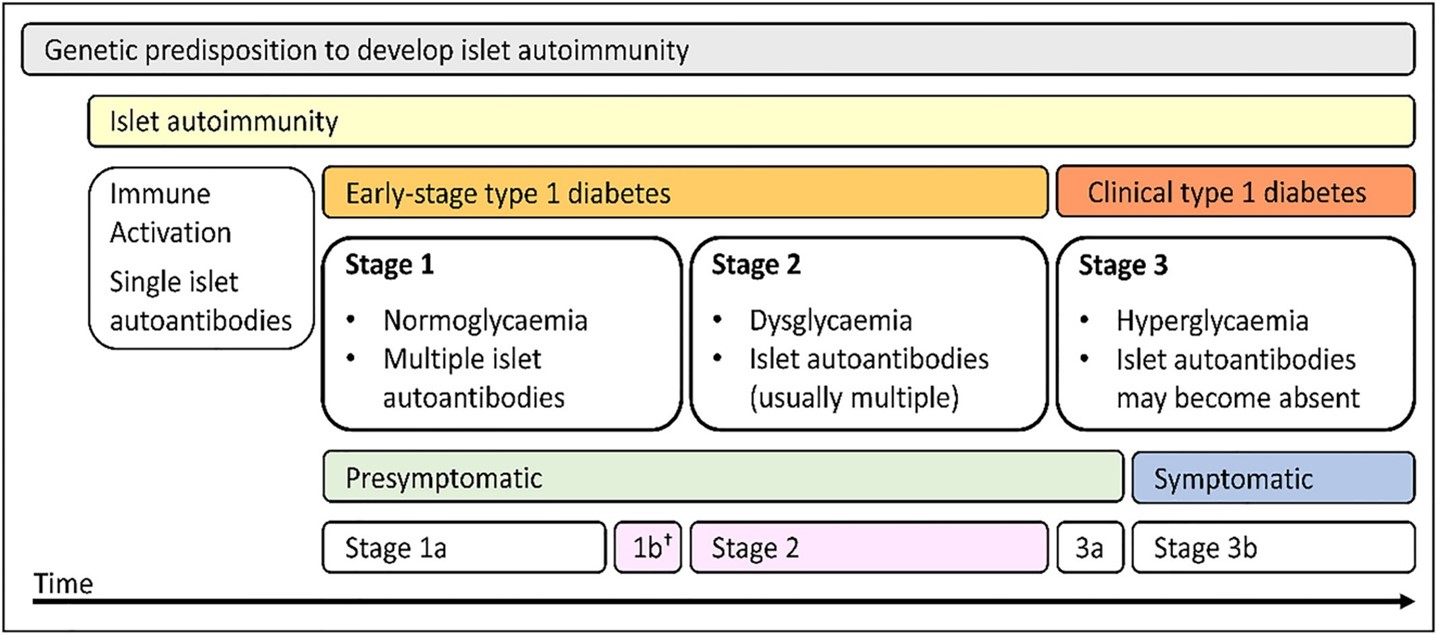
From: Hendriks AEJ, Marcovecchio ML, Besser REJ, et al. Clinical care advice for monitoring of islet autoantibody positive individuals with presymptomatic type 1 diabetes. Diabetes Metab Res Rev. 2024;40(2): e3777. doi:10.1002/dmrr.3777.
In dit verband presenteerde prof. Jacques Beltrand vervolgens de vooruitgang in de behandeling van diabetes type 1 in de afgelopen 100 jaar, waarbij hij de nadruk legde op recente ontwikkelingen die erop gericht zijn in te grijpen op de ziekte in plaats van simpelweg insuline te vervangen. De ontdekking van de NOD-muis heeft geleid tot het inzicht dat diabetes type 1 een auto-immuunziekte is waarvoor verschillende therapeutische benaderingen worden ontwikkeld, met name door zich te richten op T- en B-lymfocyten en pro-inflammatoire cytokines4. Geneesmiddelen zoals anti-CD3-antilichamen, antilymfocytenserum, abatacept, rituximab en anti-TNF-alfa zijn geëvalueerd in klinische onderzoeken7. De resultaten laten in sommige gevallen een significant behoud van de restfunctie van bètacellen zien, vooral bij kinderen6.
Prof. Vambergue presenteerde vervolgens het familiescreeningscentrum voor type 1 prediabetes in Lille, opgericht in 1996 door Pierre Fontaine en collega-kinderartsen. De follow-up van mensen in stadium 1 en 2 maakt het mogelijk om seroconversie te detecteren en te anticiperen op de ontwikkeling van diabetes. Van de 587 kinderen die tot 2020 in het onderzoek waren opgenomen, ervoer 16,4% seroconversie en 2,7% ging door naar stadium 3. De gediagnosticeerde kinderen waren gemiddeld 10 jaar oud en hadden over het algemeen verschillende soorten antilichamen8. Regelmatige follow-up voorkwam acute complicaties en verbeterde de initiële glykemische controle bij gediagnosticeerde kinderen. Er blijven echter vragen bestaan over de psychosociale impact van screening en follow-up op lange termijn, en er zijn getuigenissen gepland om een perspectief te bieden op de ervaring in dit centrum.
Ten slotte ging mevrouw Aaron-Popelier, psycholoog, in op de kwestie van de psychologische en gedragsstrategieën die individuen toepassen in het licht van ziektescreening, met name diabetes type 1 bij kinderen. Ze benadrukte het belang van het begrijpen van emotionele reacties en afweermechanismen die screeningsbeslissingen kunnen beïnvloeden.
Aaron-Popelier moedigt zorgverleners aan om een empathische benadering te hanteren, gebaseerd op luisteren en open discussie met mensen met diabetes type 1 en de mensen om hen heen, om geïnformeerde, niet-dwingende besluitvorming te ondersteunen.
Immuniteit in het hart van diabetes... en SFD2024!
Diabetes type 2 heeft een aanzienlijke klinische diversiteit, wat heeft geleid tot de verkenning van verschillende methoden om diabetespatiënten te classificeren. In 2018 stelde de Leif-groep een indeling in vijf subgroepen voor door variabelen zoals auto-antilichamen, HbA1c, leeftijd, BMI en HOMA9-indices op te nemen. Er is echter nog geen classificatie die rekening houdt met de immunoflammatoire barometer, ondanks de belangrijke rol van ontsteking bij diabetes type 2 (T2D). Om dit traject te verkennen, werden ongeveer 400 mensen met T2D gerekruteerd en werd clustering zonder toezicht uitgevoerd door zowel klinische variabelen als het aantal circulerende immuuncellen op te nemen. De resultaten onthulden vier verschillende clusters, elk met specifieke immunologische en klinische profielen. Deze gegevens suggereren de mogelijkheid om een subgroep van inflammatoire patiënten te identificeren, waardoor mogelijk de ontwikkeling van specifieke complicaties wordt voorspeld. Studies hebben bijvoorbeeld een verband aangetoond tussen het aantal circulerende monocyten en het cardiovasculaire risico bij mensen met T2D. Deze resultaten benadrukken het belang van immunologische karakterisering bij de behandeling en prognose van het type 210.
Dit resoneert met de toespraak van Prof. Nathalie Esser die op briljante wijze het INTERCEPT-T2D-project (Home - intercept-t2d) presenteerde, gericht op het vaststellen van de rol van het ontstekingsprofiel van mensen met diabetes type 2 in de vroege ontwikkeling van de organische laesies die kenmerkend zijn voor de ziekte.
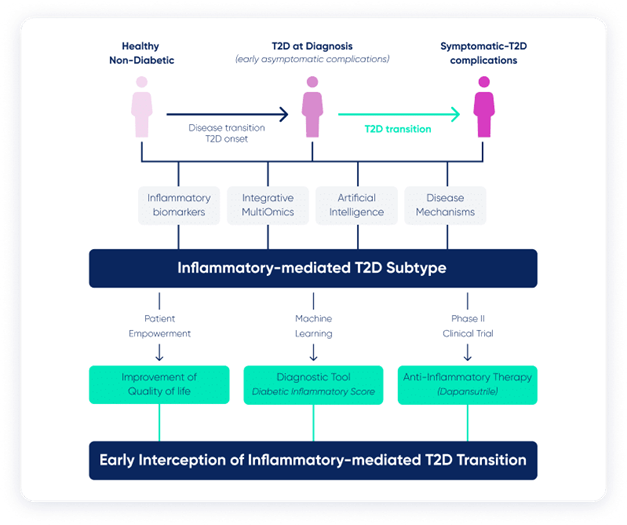
From : The project - intercept-t2d
Het programma omvat een RCT (Dapan Dia Trial: Dapansutrile in Diabetes and Diabetes-Related Complications - Dapan-Dia - Full Text View - ClinicalTrials.gov) waarvan het doel is om te evalueren of remming van het NLRP3-inflammasoom door Dapansutrile het risico op micro- en macrovasculaire complicaties bij diabetes type 2 vermindert.
Focus op de bètacel: Laten we eens kijken naar de pathogenese van diabetes!
De ontwikkeling van immunotherapieën om de progressie van diabetes type 1 te voorkomen, is een veelbelovende vooruitgang. De toename van de incidentie van deze ziekte suggereert echter een belangrijke rol voor omgevingsfactoren. Recent onderzoek koppelt anterovirale infecties van groep B aan diabetes type 1.
De directe impact van het virus op bètacellen van de alvleesklier moet echter nog worden bepaald. In deze context presenteerde Clémentine Halliez de resultaten van een studie die een direct cytopathisch effect van Coxsackievirus B (CVB) op bètacellen suggereert, onafhankelijk van de activiteit van T-cellen. Bovendien wordt intercellulaire overdracht van het virus tussen bètacellen via fylopoden waargenomen. Daarom zou de ontwikkeling van een CVB-vaccin een veelbelovende strategie kunnen zijn om diabetes type te voorkomen 111.
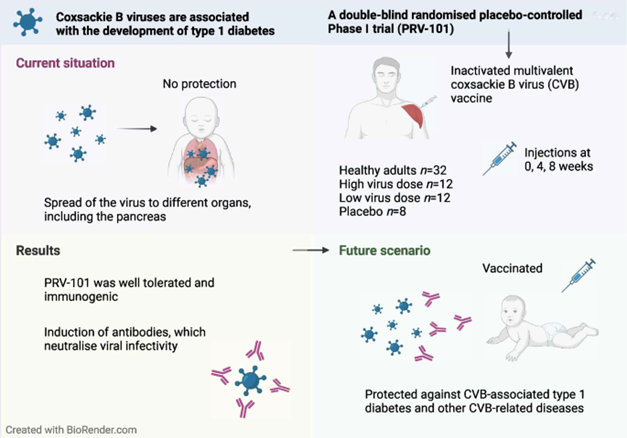
From : Hyöty H, Kääriäinen S, Laiho JE, et al. Safety, tolerability and immunogenicity of PRV-101, a multivalent vaccine targeting coxsackie B viruses (CVBs) associated with type 1 diabetes: a double-blind randomised placebo-controlled Phase I trial. Diabetologia. 2024;67(5):811-821. doi:10.1007/s00125-024-06092-w
De meest recente studies die het cruciale belang van niet-coderende RNA's, en in het bijzonder circulaire RNA's, bij de regulatie van de bètacelfunctie van de alvleesklier benadrukken, met name in de context van diabetes, werden ook gepresenteerd. Deze baanbrekende ontdekkingen maken de weg vrij voor nieuwe gerichte therapieën voor de behandeling van type 112.
Daarnaast is er uitgebreid onderzoek gedaan naar transfer-RNA-fragmenten en hun betrokkenheid bij de postnatale rijping van bètacellen van de alvleesklier, met bijzondere aandacht voor diabetes type 1. Dit werk onthult een direct verband tussen het immuunsysteem en bètacellen van de alvleesklier en biedt nieuwe inzichten om deze complexe ziekte beter te begrijpen en te behandelen13.
Het team van prof. Miriam Cnop daarentegen onderzocht endoplasmatisch reticulumstress en de verbanden met diabetes. Ze identificeerden belangrijke signaalroutes, zoals de PERK-NRF2-route, die nieuwe mogelijkheden bieden voor de ontwikkeling van innovatieve therapieën14.
Ten slotte biedt een baanbrekend onderzoek naar de interacties tussen alfa- en deltacellen en hun impact op bètacellen nieuwe inzichten in hoe we stofwisselingsstoornissen beter kunnen begrijpen en behandelen, wat de weg vrijmaakt voor meer gepersonaliseerde therapieën15.
Verwijzingen
-
Insel RA, Dunne JL, Atkinson MA, et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 2015;38(10):1964-1974. doi:10.2337/dc15-1419
-
Hendriks AEJ, Marcovecchio ML, Besser REJ, et al. Clinical care advice for monitoring of islet autoantibody positive individuals with presymptomatic type 1 diabetes. Diabetes Metab Res Rev. 2024;40(2):e3777. doi:10.1002/dmrr.3777
-
Hummel S, Carl J, Friedl N, et al. Children diagnosed with presymptomatic type 1 diabetes through public health screening have milder diabetes at clinical manifestation. Diabetologia. 2023;66(9):1633-1642. doi:10.1007/s00125-023-05953-0
-
Bluestone JA, Buckner JH, Herold KC. Immunotherapy: Building a bridge to a cure for type 1 diabetes. Science. 2021;373(6554):510-516. doi:10.1126/science.abh1654
-
Herold KC, Bundy BN, Long SA, et al. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes [published correction appears in N Engl J Med. 2020 Feb 6;382(6):586]. N Engl J Med. 2019;381(7):603-613. doi:10.1056/NEJMoa1902226
-
Ramos EL, Dayan CM, Chatenoud L, et al. Teplizumab and β-Cell Function in Newly Diagnosed Type 1 Diabetes. N Engl J Med. 2023;389(23):2151-2161. doi:10.1056/NEJMoa2308743
-
Taylor PN, Collins KS, Lam A, et al. C-peptide and metabolic outcomes in trials of disease modifying therapy in new-onset type 1 diabetes: an individual participant meta-analysis [published correction appears in Lancet Diabetes Endocrinol. 2024 Feb;12(2):e12]. Lancet Diabetes Endocrinol. 2023;11(12):915-925. doi:10.1016/S2213-8587(23)00267-X
-
Ahlqvist E, Storm P, Käräjämäki A, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018;6(5):361-369. doi:10.1016/S2213-8587(18)30051-2
-
Julla JB, Girard D, Diedisheim M, et al. Blood Monocyte Phenotype Is A Marker of Cardiovascular Risk in Type 2 Diabetes. Circ Res. 2024;134(2):189-202. doi:10.1161/CIRCRESAHA.123.322757
-
Hyöty H, Kääriäinen S, Laiho JE, et al. Safety, tolerability and immunogenicity of PRV-101, a multivalent vaccine targeting coxsackie B viruses (CVBs) associated with type 1 diabetes: a double-blind randomised placebo-controlled Phase I trial. Diabetologia. 2024;67(5):811-821. doi:10.1007/s00125-024-06092-w
-
Stoll L, Rodríguez-Trejo A, Guay C, et al. A circular RNA generated from an intron of the insulin gene controls insulin secretion. Nat Commun. 2020;11(1):5611. Published 2020 Nov 5. doi:10.1038/s41467-020-19381-w
-
Bayazit MB, Jacovetti C, Cosentino C, et al. Small RNAs derived from tRNA fragmentation regulate the functional maturation of neonatal β cells. Cell Rep. 2022;40(2):111069. doi:10.1016/j.celrep.2022.111069
-
Eizirik DL, Pasquali L, Cnop M. Pancreatic β-cells in type 1 and type 2 diabetes mellitus: different pathways to failure. Nat Rev Endocrinol. 2020;16(7):349-362. doi:10.1038/s41574-020-0355-7Jennings RE, Scharfmann R, Staels W. Transcription factors that shape the mammalian pancreas. Diabetologia. 2020;63(10):1974-1980. doi:10.1007/s00125-020-05161-0

