Ademhalingsstoornis van de late vorm van de ziekte van Pompe (LOPD)
De ziekte van Pompe: spierziekte met grote respiratoire implicaties
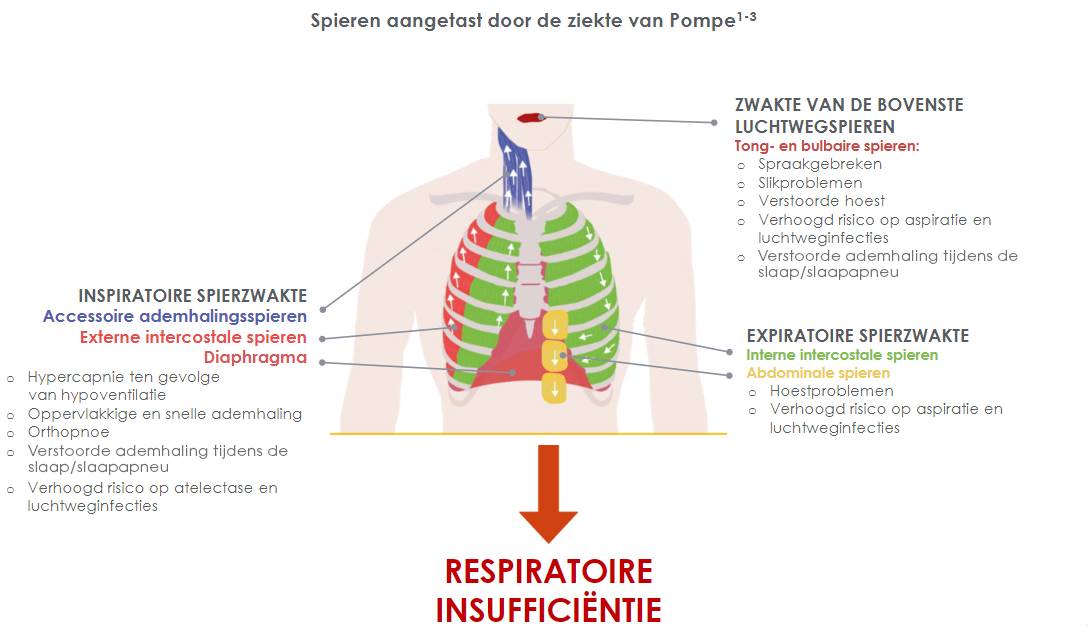
De meest prominente respiratoire symptomen:
Bij LOPD is het zwakte van de ademhalingsspieren die respiratoire disfunctie veroorzaakt.1-3
De ademhalingsproblemen bij de ziekte van Pompe zijn het gevolg van spierschade, maar worden vaak overschaduwd door het verlies van mobiliteit.4
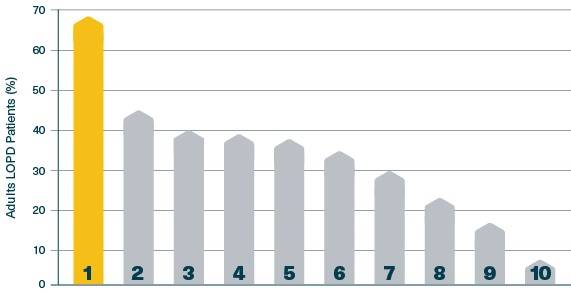
Rangschikking van de frequentie van symptomen:5
1. Kortademigheid na sport
2. Ademhalingsondersteuning
3. Niet-invasieve ventilatie
4. Verstoorde slaap/apnoe
5. Orthopnea
6. Kortademigheid bij rust
7. Ademnood
8. Pneumonie
9. Zuurstof vereist
10. Invasieve beademing vereist
Er is nog steeds een grote diagnostische ‘gap’ , en dat heeft grote gevolgen voor de patiënt.6,7
Bij patienten met de late onset vorm (LOPD) is de tijd tussen het optreden van de eerste symptomen en het verkrijgen van een diagnose 6 tot 13 jaar.6,7
De kans dat de niet-gediagnosticeerde LOPD patient rolstoelafhankelijk wordt en/ of ademhalingsondersteuning zal nodig hebben neemt jaarlijks met respectievelijk 13% en 8% toe. De mediane leeftijd van overlijden zonder behandeling is 54 jaar.5,8
De ademhalingsproblemen ontwikkelen zich frequent, en in een vroeg stadium van de ziekte.
![]()
|
Facts & Figures over de respiratoire impact bij LOPD
|
Progressieve zwakte van het diafragma is de voornaamste oorzaak van respiratoire disfunctie13
Let op de grotere verticale lengte in de Pompe patiënt vergeleken met de gezonde vrijwilliger.13
MR beelden bi maximale inspiratie
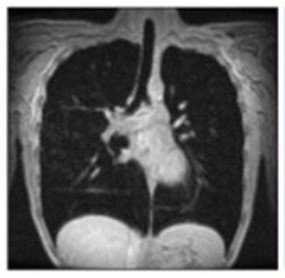 Gezonde vrijwilliger
Gezonde vrijwilliger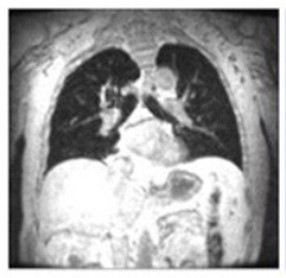 Pompe patiënt
Pompe patiënt
De aantasting van de spier vermindert de beweeglijkheid en de functie van het diafragma, en kan uiteindelijk evolueren tot de verlamming ervan.14
Initieel manifesteert de spierzwakte zich gedurende de slaap, ten gevolge van het effect van de zwaartekracht in ruglig.1,13-14 Tot op zekere hoogte wordt de verminderde werking van het diafragma gecompenseerd door de intercostale, de accessoire en abdominale ademhalingsspieren.15
Testcriteria: Onverklaard restrictief respiratoir longlijden en/of proximale en axiale spierzwakte en/of asymptomatische verhoogde CK

- Overweeg het opnieuw testen van patienten met restrictief respiratoir longlijden, want het zou de ziekte van Pompe kunnen zijn.22
Uit recente studies is gebleken dat er een grote diagnostische yield is bij patiënten die zich initieel presenteren met respiratoire insufficiëntie.16,17
Zo bleek 1,4% van 140 patiënten met het testcriterium “neuromusculaire stoornis met respiratoire implicaties” positief te testen voor Pompe16, en in de groep met verlamming van het diafragma was het percentage zelfs 16,7%.17
- Proximale/axiale spierzwakte (Limb Girdle Muscle Disease)23
Proximale spierzwakte maakt dagdagelijkse activiteiten een uitdaging voor Pompe patiënten.10
80% van de LOPD patiënten geven aan problemen te hebben met dagelijkse taken door vermindering van spierkracht en –functie.18
Zo heeft bij de diagnose 50 % van de patienten moeite om uit een stoel op te staan, ondervindt bijna de helft hinder bij werk of studie, en is >20% rolstoelafhankelijk, of afhankelijk van respiratoire ondersteuning.18
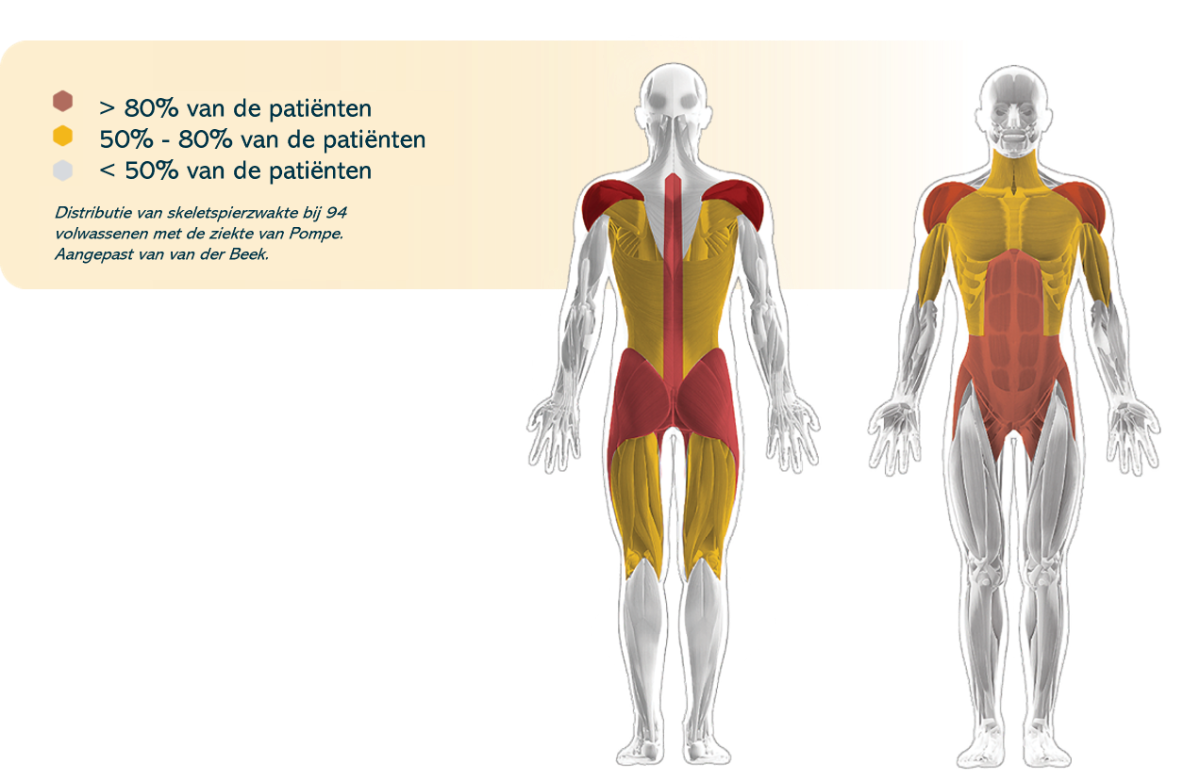
Proximale spieren in de onderste ledematen zijn over het algemeen ernstiger aangetast dan proximale spieren in de bovenste ledematen24
Romp-, paraspinale en buikspieren worden vaak vroeg in het verloop van de ziekte aangetast5
- Asymptomatische hyperCKemie22

Bij 9/10 LOPD patiënten zijn de serum Creatinine Kinase levels verhoogd door spierafbraak.6,19
De CK waarden zijn vaak licht tot matig verhoogd: 1 tot 1,5 keer de bovenste grens van normaal.21
Normale CK waarden sluiten niet noodzakelijkerwijs LOPD uit.21
Verhoogde CK waarden worden ook vaker gezien met verhoogde leverenzymes: Alanine transaminase (ALT), Aspartaat transaminase (AST), Lactaat dehydrogenase (LDH)20
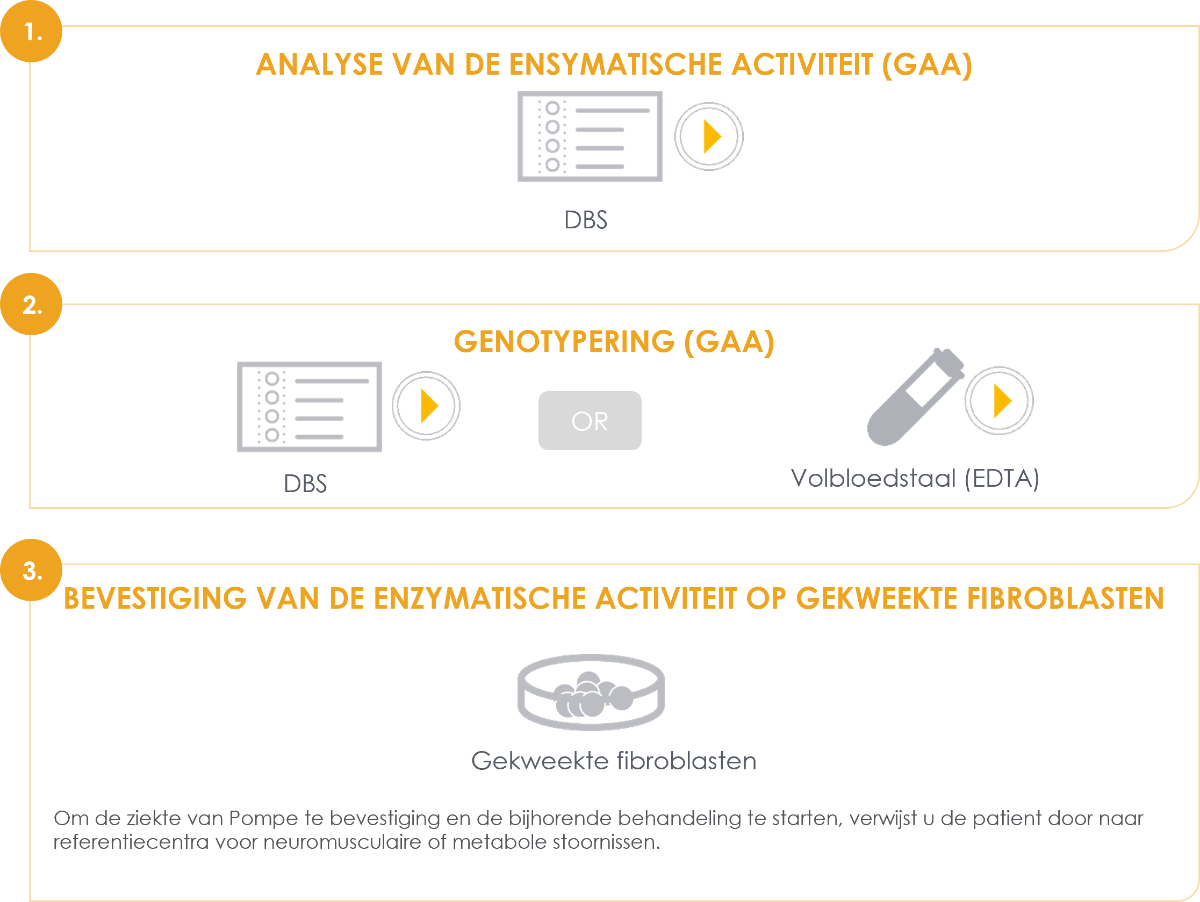
De diagnose wordt gesteld in 3 stappen: op een DBS (Dry Blood Spot) kaartje wordt de residuele enzymactiviteit gemeten. Wanneer deze sterk verminderd is volgt genetische bevestiging op DBS of volbloedstaal, en tot slot wordt in het NMRC een test ter bevestiging van de verminderde enzymactiviteit op gekweekte fibroblasten gedaan.
Meer weten?
- Ik ben geïnteresseerd om meer te weten over de behandelingsmogelijkheden van de ziekte
- Ik wil graag een testkit met DBS kaartjes en gebruiksaanwijzing, en een overzicht van de referentiecentra
Heeft u nog andere vragen? U kunt ze per mail sturen naar uw product specialist:
- Andy.verdeyen@sanofi.com voor het Noordoosten van Vlaanderen;
- Stefanie.leleu@sanofi.com voor het Noordwesten.
- Kishnani PS et al. Genet Med 2006; 8(5): 267-88. 2.Perrin C et al. Muscle Nerve 2004; 29(1): 5-27. 3. van der Beek NA et al. Orphanet J Rare Dis 2012; 7(1): 88. 4. Cupler et al. Muscle Nerve 2012; 45(3): 319-333. 5. Byrne et al. Mol Genet Metab 2011; 103(1): 1-11. 6. Kishnani PS et al. On behalf of the Pompe Registry boards of advisors. Am J Med Genet. 2013; 161 A(10): 2431-2443. 7. Vanherpe P et al. Orphanet J Rare Dis 2020; 15: 83. 8. Hagemans et al. Neurology; 64: 2139-2141. 9. Raben et al. Curr Mol Med 2002; 2: 145-66. 10. Wokke JH et al. Muscle nerve et al. 2008; 38(4): 1236-45. 11. Boentert M et al. Int J Sci 2016; 17(10): E1735. 12. Winkel LPH et al. J Neurol 2005; 2525(80): 875-884. 13. Wens SC et al. BMC Pulm Med. 2015;15:54. 14. Newsom DJM et al. Q J Med 1976; 177: 87-100. 15. Mogalle K et al. PLoS ONE 2016; 11(7): e0158912. 16. Confalonieri M et al. Orphanet J Rare Dis 2019; 14(1): 62. 17. Guimaraes MJ et al. Rev Port Pneumol 2017; 23(4). 18. Rigter T et al. Mol Genet Metab 2012; 107(3): 449-455. 19. Toscano A, Schoser B J Neurol 2013; 260: 951-959. 20. Toscano et al. Ann Transl Med 2019; 7(13): 284. 21. AANEM. Muscle Nerver 2009; 40(1): 149-160. 22. Toscano et al. Acta Myol 2013; 32(2): 78-81. 23. Preisler et al. Mol Genet Metab 2013; 110(3): 287-9. 24. Reuser, Arnold J. J., et al. “Pompe Disease: Glycogen Storage Disease Type II, Acid alpha-glucosidase (Acid Maltase) Deficiency.” The OMMBID Eds. David L. Valle, et al. McGraw Hill, 2019


.jpg)