Chronische Rhinosinusitis mit Nasenpolypen (CRSwNP)
DUPIXENT® ist indiziert als Add-on-Therapie mit intranasalen Kortikosteroiden bei Erwachsenen mit schwerer CRSwNP, die mit systemischen Kortikosteroiden und/oder operativem Eingriff nicht ausreichend kontrolliert werden kann.1
Jetzt Kostengutsprache-Formular herunterladen
Wirkmechanismus bei der Typ-2-Entzündung
Typ-2-Entzündung als Hauptursache der CRSwNP2–4

DUPIXENT® bekämpft die Typ-2-Entzündung wirksam über die Hemmung von IL-4- und IL-13-Signalwegen3

Grafik entwickelt von Sanofi; modifiziert nach einigen Aussagen von Gandhi NA et al.3
*Von den mit DUPIXENT® behandelten Patienten erreichte ein grösserer Anteil im Vergleich zu Placebo (31%) eine 1-Punkt-Verbesserung des NPS (Nasal Polyp Score) oder eines der anderen Scores, z.B. NC (Nasal Congestion) und LoS (Loss of smell) in Woche 52.
Schnelle und anhaltende Wirksamkeit
DUPIXENT® reduzierte schnell und anhaltend die nasale Obstruktion6

*gegenüber Baseline 2.48 vs. 16 % Verbesserung mit Placebo gegenüber Baseline 2.38 (LSM-Differenz: –0.98 [95 %-KI: –1.17, –0.79]; p < 0.0001).
DUPIXENT® reduzierte die Polypenlast sicht- und messbar6
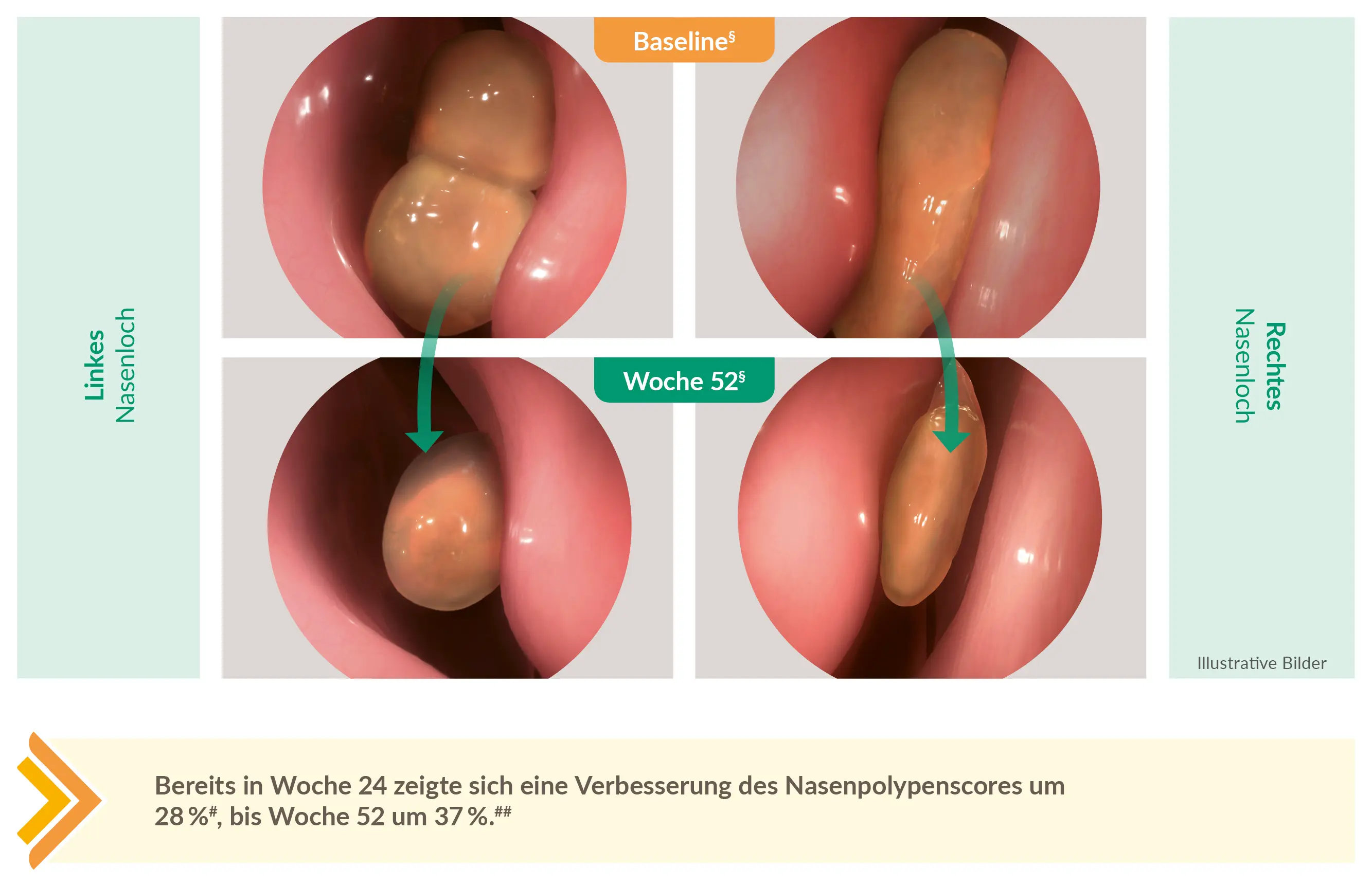
#28 % Verbesserung in Woche 24 (primärer Endpunkt) mit DUPIXENT® 300 mg q2w + INCS vs. 2 % Verschlechterung mit Placebo + INCS; DUPIXENT® q2w + INCS (gepoolte DUPIXENT®-Arme), n = 295 (–1.71 gegenüber Baseline 6.18) vs. Placebo + INCS, n = 153 (+ 0.10 gegenüber Baseline 5.96; LSM-Differenz: –1.80 [95 %-KI: –2.10, –1.51] nach 52 Wochen; p < 0.0001); Daten für Studienarm mit 300 mg q2w-q4w Dosierung nicht gezeigt.
##37 % Verbesserung in Woche 52 (sekundärer Endpunkt) mit DUPIXENT® 300 mg q2w + INCS vs. 3 % Verschlechterung mit Placebo + INCS; DUPIXENT® 300 mg q2w + INCS, n = 150 (–2.24 gegenüber Baseline 6.07) vs. Placebo + INCS, n = 153 (+0.15 gegenüber Baseline von 5.96; LSM-Differenz: –2.40 [95 %-KI: –2.77, –2.02] nach 52 Wochen; p < 0.0001); Daten für Studienarm mit 300 mg q2w-q4w Dosierung nicht gezeigt.
§Bilateraler endoskopischer Nasenpolypenscore (NPS); Polypen auf jeder Seite der Nase wurden verblindet auf einer Kategorienskala eingestuft: 0 = keine Polypen; 1 = kleine Polypen im mittleren Nasengang, die nicht unter den unteren Rand der mittleren Nasenmuschel reichen; 2 = Polypen, die unter den unteren Rand der mittleren Nasenmuschel reichen; 3 = grosse Polypen, die den unteren Rand der unteren Nasenmuschel erreichen oder Polypen mittig in der mittleren Nasenmuschel; 4 = grosse Polypen, die eine vollständige Obstruktion der unteren Nasenhöhle verursachen. Der Gesamtscore ergab sich aus der Summe der rechten und linken Scores – ein verringerter Score zeigt eine Verbesserung an. Endoskopiebilder wurden von Patientenbildern adaptiert; nur zu Illustrationszwecken. Individuelle Ergebnisse können abweichen.
DUPIXENT® ermöglichte eine Rückkehr des Geruchssinns6

Daten für Studienarm mit 300 mg q2w-q4w Dosierung nicht gezeigt. Modifiziert nach Bachert C et al.6
*Der University of Pennsylvania Smell Identification Test (UPSIT) bewertet die Riechfunktion mit einem 40-teiligen Riechtest. Die Punktzahl reicht von 0 bis 40: 35–40 = normale Geruchswahrnehmung; 31–34 = schwache Mikrosmie; 26–30 = moderate Mikrosmie; 19–25 = schwere Mikrosmie; < 18 = Anosmie – ein höherer Wert bedeutet eine Verbesserung.
**mit DUPIXENT® gegenüber Baseline von 13.46 vs. 6 % Verschlechterung mit Placebo gegenüber Baseline von 13.78 (LSM-Differenz: 10.30 (95 %-KI: 8.50, 12.10).
#79 % (n = 228/287) der Patienten im gepoolten Arm, die DUPIXENT® 300 mg q2w + INCS bekamen, hatten zu Beginn der Behandlung eine Anosmie. In Woche 24 waren es lediglich noch
30 % (n = 84/280) gemäss UPSIT-Score.6
##In der SINUS-24-Studie hatten 24 % der Patienten nach 24 Wochen unter Dupilumab eine Anosmie (UPSIT-Score < 18) vs. 74 % zu Studienbeginn.6 Dies bedeutet eine Reduktion um
67,6 % der Patienten mit Anosmie.
Zweiwöchentliche Dosierung1

Günstiges Sicherheitsprofil6
DUPIXENT® hat ein günstiges Sicherheitsprofil und ist gut verträglich6

Gepoolte Analyse der LIBERTY-SINUS-24- und SINUS-52-Studien nach 24 Wochen. Daten für Studienarm mit 300 mg q2w-q4w Dosierung nicht gezeigt.
*Die Reaktion an der Injektionsstelle war ein im Protokoll angegebenes unerwünschtes Ereignis von besonderem Interesse.
- DUPIXENT® (Dupilumab) Fachinformation, Stand August 2023, www.swissmedicinfo.ch.
- Chaaban MR et al. Epidemiology and differential diagnosis of nasal polyps. Am J Rhinol Allergy 2013; 27(6): 473–8.
- Gandhi NA et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2016; 15(1): 35–50.
- Schleimer RP. Immunopathogenesis of chronic rhinosinusitis and nasal polyposis. Annu Rev Pathol 2017;12: 331–57.
- Bachert C et al. Responder analysis to demonstrate the effect of targeting type 2 inflammatory mechanisms with dupilumab across objective and patient-reported endpoints for patients with severe chronic rhinosinusitis with nasal polyps in the SINUS-24 and SINUS-52 studies. Clin Exp Allergy 2022; 52: 244–9.
- Bachert C et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52). Lancet 2019; 394(10209): 1638–50.
CRSwNP = chronische Rhinosinusitis mit Nasenpolypen; IL = Interleukin; INCS = intranasales Kortikosteroid; KI = Konfidenzintervall; LS = kleinste Quadrate (least squares)/Methode der kleinsten Quadrate; MedDRA = medizinisches Wörterbuch für Aktivitäten im Rahmen der Arzneimittelzulassung; NC = nasale Kongestion/Obstruktion; PT = bevorzugte Bezeichnung; q2w = alle 2 Wochen; q4w = alle 4 Wochen; TEAE = während der Behandlung aufgetretenes unerwünschtes Ereignis; UPSIT = University of Pennsylvania Smell Identification Test.
Alle Referenzen werden von Sanofi auf Anfrage zur Verfügung gestellt.
Dupixent®. W: Dupilumab. I: Bei Kindern <12 Jahren (J.) nur als Fertigspritze indiziert. Dupixent ist zugelassen bei: Patienten (Pat.) ≥6 Monaten (M.) mit mittelschwerer/schwerer atopischer Dermatitis (AD) und (u.) für die Behandlung (Behlg.) Erwachsener (Erw.) mit mittelschwerer-schwerer Prurigo Nodularis (PN), wenn eine Therapie mit verschreibungspflichtigen, topischen Behlg. keine angemessene Krankheitskontrolle ermöglicht oder (o.) nicht empfohlen wird. Dupixent kann mit o. ohne topische Kortikosteroide (KS) angewendet werden. Als Add-on-Erhaltungstherapie bei Pat. ≥6J. mit schwerem Asthma u. folgenden Kriterien: *Eosinophilenzahl im Blut ≥150 Zellen/µL, unzureichender Asthmakontrolle u. ≥1 schwere Exazerbation in letzten 12M. (trotz inhalativer KS u. lang wirksamer Bronchodilatatoren); *o. Dauerbehlg. mit systemischen KS. Als Add-on-Therapie mit intranasalen KS bei Erw. mit schwerer chronischer Rhinosinusitis mit Nasenpolypen (CRSwNP), die mit systemischen KS u./o. operativem Eingriff nicht ausreichend kontrolliert werden kann, sowie bei Pat. ≥12J., ≥40kg mit eosinophiler Ösophagitis (EoE), die mit einer konventionellen medikamentösen Therapie unzureichend therapiert sind, diese nicht vertragen o. für die eine solche Behlg. nicht in Betracht kommt. D: Dupixent wird subkutan injiziert. AD/PN: Erw.: Anfangsdosis (AnfDos.) 600mg, danach 300mg alle 2 Wochen (q2w). AD: Kinder/Jugendliche (Jug.) (6-17J.): 15kg - <30kg: AnfDos. 300mg (Tag 1) u. 300mg (Tag 15), danach 300mg alle 4 Wochen (q4w); 30kg - <60kg: AnfDos. 400mg, danach 200mg q2w; ≥60kg: AnfDos. 600mg, danach 300mg q2w. AD: Kinder (6M.-5J.): 5kg - <15kg: 200mg q4w; 15kg - <30kg: 300mg q4w. Asthma: Erw./Jug. (≥12J.): *Bei schwerem Asthma, unter inhalativen KS u. lang wirksamen Bronchodilatatoren: AnfDos. 400mg, danach 200mg q2w. *Bei schwerem Asthma, unter oralen KS: AnfDos. 600mg, danach 300mg q2w. Kinder (6-11J.): 15kg - <30kg: 300mg q4w; 30kg - <60kg: 200mg q2w o. 300mg q4w; ≥60kg: 200mg q2w. CRSwNP: Erw.: 300mg q2w. EoE: Erw./Jug. (≥12J.) 300mg qw. Andere Indikationen: siehe Fachinformation. KI: Überempfindlichkeit gegen Wirkstoff/Hilfsstoff. VM: enthält Natrium (<1mmol/Dosis). Überempfindlichkeitsreaktionen: Bei allgemeiner systemischer Überempfindlichkeit (unmittelbar o. verzögert) Anwendung von Dupixent sofort beenden u. geeignete Behlg. einleiten. Hypereosinophilie: Unter Dupixent-Therapie wurden Fälle eosinophiler Pneumonie u. Vaskulitis, die mit eosinophiler Granulomatose mit Polyangitis verbunden sind, berichtet. Bei Pat. mit Hypereosinophilie sollte Arzt besonders auf Auftreten von vaskulitischem Hautausschlag, Verschlechterung der Lungensymptomatik, Herzkomplikationen u./o. Neuropathie achten. Vorbestehende Helminthose: vor Dupixent-Therapie behandeln. Bei Infektion während Dupixent-Behlg. u. Nichtansprechen auf Helminthose-Behlg. muss Dupixent absetzt werden, bis Infektion abgeklungen ist. Konjunktivitis/Keratitis: Bei Pat. mit AD wurde über Konjunktivitis u. Keratitis mit Dupixent berichtet. Pat. u. Personen, die kleine Kinder betreuen, müssen neu auftretende o. sich verschlimmernde Augensymptome Arzt mitteilen. Pat. (inkl. Säuglinge u. Kleinkinder), die unter Dupixent-Behlg. eine Konjunktivitis entwickeln, die nach Standardbehlg. nicht abklingt o. die Anzeichen einer Keratitis entwickeln, sollten sich gegebenenfalls einer ophthalmologischen Untersuchung unterziehen. Pat. mit Asthma: Anpassung der Asthma-Behlg. nur in Absprache mit Arzt. Nach Absetzen der Behlg. Pat. sorgfältig überwachen. IA: Gleichzeitige Anwendung von Lebendimpfstoffen vermeiden. NW: Reaktionen/Ödem an Injektionsstelle, Konjunktivitis, Augenjucken, Blepharitis, Herpes labialis, (Hyper-)Eosinophilie, Arthralgien, Schlaflosigkeit, Gastritis, Enterobiasis, Kopf- u. Zahnschmerzen. P: Dupixent, je 2 Fertigspritzen/-pens, 200mg o. 300mg. AK: B. ZI: sanofi-aventis (schweiz) ag, 3, route de Montfleury, 1214 Vernier. Weitere Informationen unter www.swissmedicinfo.ch. Stand der Information: August 2023_2
MAT-CH-2301935-2.0-12/2023

.2023-03-17-10-37-29.png)

