Polypose naso-sinusienne (PNS)
DUPIXENT® est indiqué en tant que traitement additionnel aux corticostéroïdes par voie nasale chez les adultes présentant une PNS sévère qui ne peut pas être suffisamment contrôlée par des corticostéroïdes systémiques et/ou une intervention chirurgicale.1
Télécharger le formulaire de garantie de prise en charge
Mécanisme d'action dans l'inflammation de type 2
Inflammation de type 2 comme cause principale de la PNS2-4

DUPIXENT® combat efficacement l’inflammation de type 2 en inhibant les voies de signalisation de l’IL-4 et de l’IL-133

Graphique développé par Sanofi ; modifié d’après certaines affirmations de Gandhi NA et al.3
* Parmi les patients traités par DUPIXENT®, une plus grande proportion a obtenu, par rapport au placebo (31 %), une amélioration de ≥1 point du score NPS (score des polypes nasaux) ou de l’un des autres scores, comme le NC (congestion nasale) et le LoS (perte d’odorat) à la semaine 52.
Efficacité rapide et durable
DUPIXENT® réduit rapidement et durablement l’obstruction nasale6

*par rapport à la valeur initiale de 2,48 vs 16 % d’amélioration avec le placebo par rapport à l’inclusion 2,38 (différence LSM : –0,98 [IC à 95 % : –1,17, –0,79] ; p < 0,0001)
DUPIXENT® réduit la charge liée aux polypes de manière visible et mesurable6
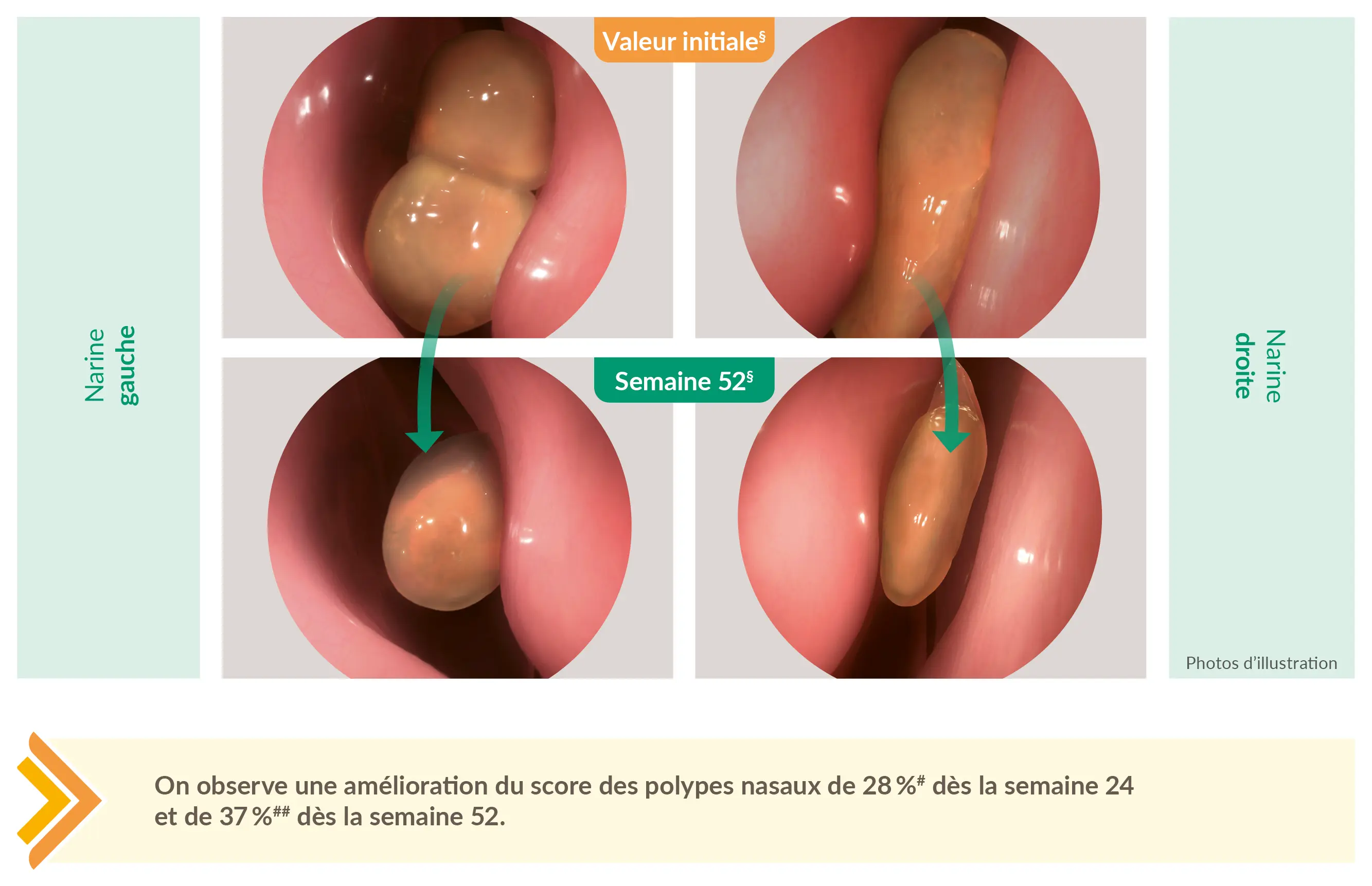
#28 % d’amélioration à la semaine 24 (critère principal) avec DUPIXENT® 300 mg q2w + INCS vs 2 % de dégradation avec placebo + INCS ; DUPIXENT® q2w + INCS (bras DUPIXENT® regroupés), n = 295 (–1,71 vs inclusion 6,18) vs placebo + INCS, n = 153 (+ 0,10 vs inclusion 5,96; différence LSM : –1,80 [IC à 95 % : –2,10, –1,51] après 52 semaines ; p < 0,0001) ; données non affichées pour le bras avec le dosage de 300 mg q2w-q4w ;
##37 % d’amélioration à la semaine 52 (critère secondaire) avec DUPIXENT® 300 mg q2w + INCS vs 3 % de dégradation avec placebo + INCS ; DUPIXENT® 300 mg q2w + INCS, n = 150
(–2,24 vs inclusion 6,07) vs placebo + INCS, n = 153 (+0,15 vs inclusion 5,96; différence MMC : –2,40 [IC à 95 % : –2,77, –2,02] après 52 semaines ; p < 0,0001) ; les données du bras avec le dosage 300 mg q2w-q4w ne sont pas indiquées.
§Score des polypes nasaux (NPS) bilatéral endoscopique ; de chaque côté du nez, les polypes ont été classés en aveugle sur une échelle de catégorie : 0 = absence de polypes ; 1 = petits polypes du méat nasal moyen n’atteignant pas le bord inférieur du cornet nasal moyen ; 2 = polypes atteignant le bord inférieur du cornet nasal moyen ; 3 = polypes volumineux atteignant le bord inférieur du cornet nasal moyen ou polypes situés au centre du cornet nasal moyen ; 4 = polypes volumineux entraînant une obstruction totale de la cavité nasale inférieure.
Le score total est la somme des scores gauche et droit – une réduction du score indique une amélioration. Les images endoscopiques ont été adaptées à partir des images des patients ; uniquement à des fins d’illustration. Les résultats individuels peuvent différer.
DUPIXENT® permet le rétablissement de l’odorat6

Les données du bras de l’étude avec le dosage de 300 mg q2w-q4w ne sont pas présentées. Modifié d’après Bachert C et al.6
*L’University of Pennsylvania Smell Identification Test (UPSIT) évalue la fonction de l’odorat à l’aide d’un test portant sur 40 odeurs. Le score va de 0 à 40 points : 35–40 = perception olfactive normale ; 31–34 = microsmie légère ; 26–30 = microsmie modérée ; 19–25 = microsmie sévère ; < 18 = anosmie – une valeur supérieure indique une amélioration.
**avec DUPIXENT® par rapport à la valeur initiale de 13,46 vs 6 % de dégradation avec le placebo par rapport à la valeur initiale de 13,78 (différence LSM : 10,30 [IC à 95 % : 8,50, 12,10]).
#79 % (n = 228/287) des patients dans le bras regroupé, qui ont reçu DUPIXENT® 300 mg q2w + INCS, présentaient une anosmie au début du traitement. À la semaine 24, il ne s’agissait plus que de 30 % (n = 84/280) selon le score UPSIT.6
##Dans l’étude SINUS-24, 24 % des patients sous dupilumab présentaient une anosmie après 24 semaines (score UPSIT< 18) 12 vs 74 % au début de l’étude.6 Cela correspond à une réduction de 67,6 % des patients avec anosmie.
Administration bihebdomadaire1

Profil de sécurité favorable6
DUPIXENT® présente un profil de sécurité favorable et est bien toléré6

Analyse poolée des études LIBERTY SINUS 24 et SINUS 52 après 24 semaines. Les données du bras de l’étude avec le dosage de 300 mg q2w-q4w ne sont pas présentées.
*La réaction au site d’injection était indiquée dans le protocole comme un évènement indésirable d’intérêt particulier.
- DUPIXENT® (Dupilumab) information professionnelle, mise à jour : août 2023, www.swissmedicinfo.ch.
- Chaaban MR et al. Epidemiology and differential diagnosis of nasal polyps. Am J Rhinol Allergy 2013; 27(6): 473–8.
- Gandhi NA et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2016; 15(1): 35–50.
- Schleimer RP. Immunopathogenesis of chronic rhinosinusitis and nasal polyposis. Annu Rev Pathol 2017;12: 331–57.
- Bachert C et al. Responder analysis to demonstrate the effect of targeting type 2 inflammatory mechanisms with dupilumab across objective and patient-reported endpoints for patients with severe chronic rhinosinusitis with nasal polyps in the SINUS-24 and SINUS-52 studies. Clin Exp Allergy 2022; 52: 244–9.
- Bachert C et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52). Lancet 2019; 394(10209): 1638–50.
IC = intervalle de confiance ; IL = interleukine ; INCS = corticostéroïde intranasal ; LS = moindres carré MedDRA = dictionnaire médical pour les aff aires règlementaires ; NC = congestion/obstruction nasale ; PNS = polypose naso-sinusienne ; PT = terme préférentiel ; q2w = toutes les 2 semaines ; q4w = toutes les 4 semaines ; TEAE = évènement indésirable associé aux soins ; UPSIT = University of Pennsylvania Smell Identifi cation Test.
Toutes les références sont mises à disposition sur demande par Sanofi.
Dupixent®. PA: Dupilumab. I: Pour le traitement des enfants <12 ans (a.), seule la seringue préremplie est indiquée. Dupixent est autorisé: chez les patients (pat.) ≥6 mois (m.) atteints de dermatite atopique (DA) modérée à sévère et chez les adultes (ad.) atteints de prurigo nodulaire (PN) modéré à sévère, dont la maladie n'est pas contrôlée de manière adéquate par des traitements (trait.) topiques sur ordonnance ou lorsque ces trait. ne sont pas recommandés. Dupixent peut être utilisé avec ou sans corticostéroïdes (CS) topiques. Il est également autorisé comme trait. d’entretien d’appoint chez les pat. ≥6 a. souffrant d’asthme sévère et répondant aux critères suivants: *nombre d’éosinophiles dans le sang ≥150 cellules/µl, contrôle insuffisant de l’asthme et ≥1 exacerbation sévère au cours des 12 m. précédents (malgré la prise de CS inhalés et de bronchodilatateurs à action prolongée); *ou trait. permanent par des CS systémiques. Comme trait. additionnel aux CS intranasaux chez les ad. présentant une polypose naso-sinusienne (PNS) sévère insuffisamment contrôlée par des CS systémiques et/ou la chirurgie, ainsi que chez des pat. ≥12 a., ≥40kg atteints d’œsophagite à éosinophiles (EoE), en cas d'échec, de contre-indication ou d'intolérance aux trait. médicamenteux conventionnels. PO: Le dupixent est injecté par voie sous-cutanée. DA/PN: Ad.: dose initiale (dose init.) de 600 mg, puis 300 mg toutes les 2 semaines (q2w). DA: Enfants/adolescents (ado.) (6 à 17 a.): 15kg - <30kg: dose init. de 300 mg (Jour 1) et 300 mg (Jour 15), puis 300 mg toutes les 4 semaines (q4w); 30kg - <60kg: dose init. de 400 mg, puis 200 mg q2w; ≥60kg: dose init. de 600 mg, puis 300 mg q2w. DA: Enfants (6 m. à 5 a.): 5kg - <15kg: 200 mg q4w; 15kg - <30kg: 300 mg q4w. Asthme: Ad./Ado. (≥12 a.): *en cas d’asthme sévère traité par des CS inhalés/bronchodilatateurs à action prolongée: dose init. de 400 mg, puis 200 mg q2w. *en cas d’asthme sévère traité par des CS oraux: dose init. de 600 mg, puis 300 mg q2w. Enfants (6 à 11 a.): 15kg - <30kg: 300 mg q4w; 30kg - <60kg: 200 mg q2w ou 300 mg q4w; ≥60kg: 200 mg q2w. PNS: Ad.: 300 mg q2w. EoE: Ad./Ado. (≥12 a.) 300 mg qw. Autres indications: voir Information professionnelle. CI: hypersensibilité à la substance active/à l’un des excipients. PR: contient du sodium (<1mmol/dose). Réactions d’hypersensibilité: en cas d’hypersensibilité systémique générale (immédiate ou retardée), stopper immédiatement l’administration de dupixent et initier un trait. approprié. Hyperéosinophilie: des cas de pneumonie à éosinophiles et vascularite en rapport avec une granulomatose éosinophilique avec polyangéite ont été rapportés chez des pat. traités avec dupixent. En cas d’hyperéosinophilie, les médecins doivent être attentifs à l'apparition de lésions cutanées de vascularite, une aggravation des symptômes pulmonaires, des complications cardiaques et/ou une neuropathie. Helminthiase préexistante: à traiter avant le trait. par dupixent. En cas d’infection pendant le trait. par dupixent et en l’absence de réponse au trait. contre les helminthes, arrêter l’administration de dupixent jusqu’à la disparition de l’infection. Conjonctivite/kératite: Des cas de conjonctivite et kératite ont été signalés avec dupixent chez des pat. atteints de DA. Pat. et personnes qui s’occupent d’enfants en bas âge doivent signaler toute nouvelle apparition ou l'aggravation des symptômes oculaires à leur médecin. Pat., y compris les nourrissons et les tout petits, traités par dupixent qui développent une conjonctivite qui n’est pas résolue après un trait. standard ou qui développent des signes et symptômes évoquant une kératite doivent suivre un examen ophtalmologique le cas échéant. Pat. souffrant d’asthme: adaptation du trait. antiasthmatique uniquement après avoir consulté le médecin. Surveiller attentivement les pat. après l’arrêt du trait. IA: éviter toute utilisation concomitante de vaccins vivants. EI: réactions/œdèmes au site d’injection, conjonctivite, prurit oculaire, blépharite, herpès labial, (hyper)éosinophilie, arthralgie, insomnie, gastrite, entérobiase, céphalées et maux de dents. Pr: Dupixent, 2 seringues/stylos prérempli(e)s de 200 mg ou 300 mg. CR: B. TA: sanofi-aventis (Suisse) ag, 3, route de Montfleury, 1214 Vernier. Plus d’informations sur http://www.swissmedicinfo.ch. Mise à jour de l’information: août 2023_2
MAT-CH-2301936-1.0-01/2024

.2023-03-17-10-37-29.png)
