Enfermedad de Fabry : Guía completa sobre esta condición genética
Entender como dar a cada paciente la oportunidad de vivir su mejor vida.
Enfermedad de Fabry
Genética y Diagnóstico
¿Qué es la Enfermedad de Fabry (EF)? 1,2
- La EF, también conocida como Anderson-Fabry, es un trastorno de depósito lisosomal poco frecuente, de carácter hereditario ligado al cromosoma X, con una prevalencia estimada de:
- 1:40.000 en hombres
- 1:20.000 en mujeres.
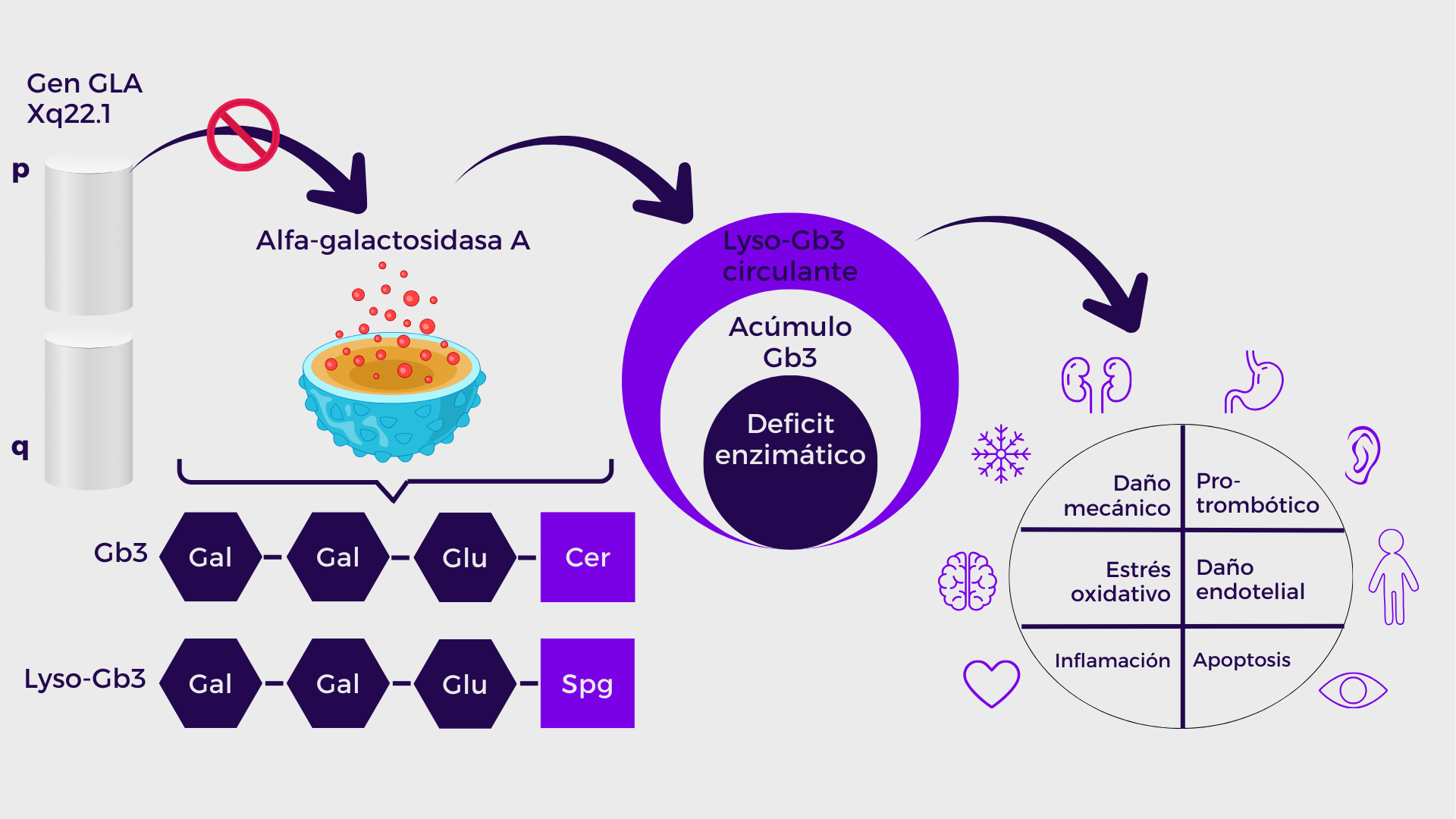
- Está causada por variantes patogénicas del gen GLA (Xq22.1), que codifica la enzima α-galactosidasa A (α-GalA).
- La deficiencia, total o parcial, de esta enzima produce la acumulación de glicoesfingolípidos, principalmente globotriaosilceramida (Gb3) y globotriaosilesfingosina (Lyso-Gb3).
- El acúmulo de estos metabolitos desencadena daño multisistémico crónico y progresivo, afectando riñón, corazón, sistema nervioso y el endotelio vascular, generando deterioro en la calidad de vida y menor supervivencia.
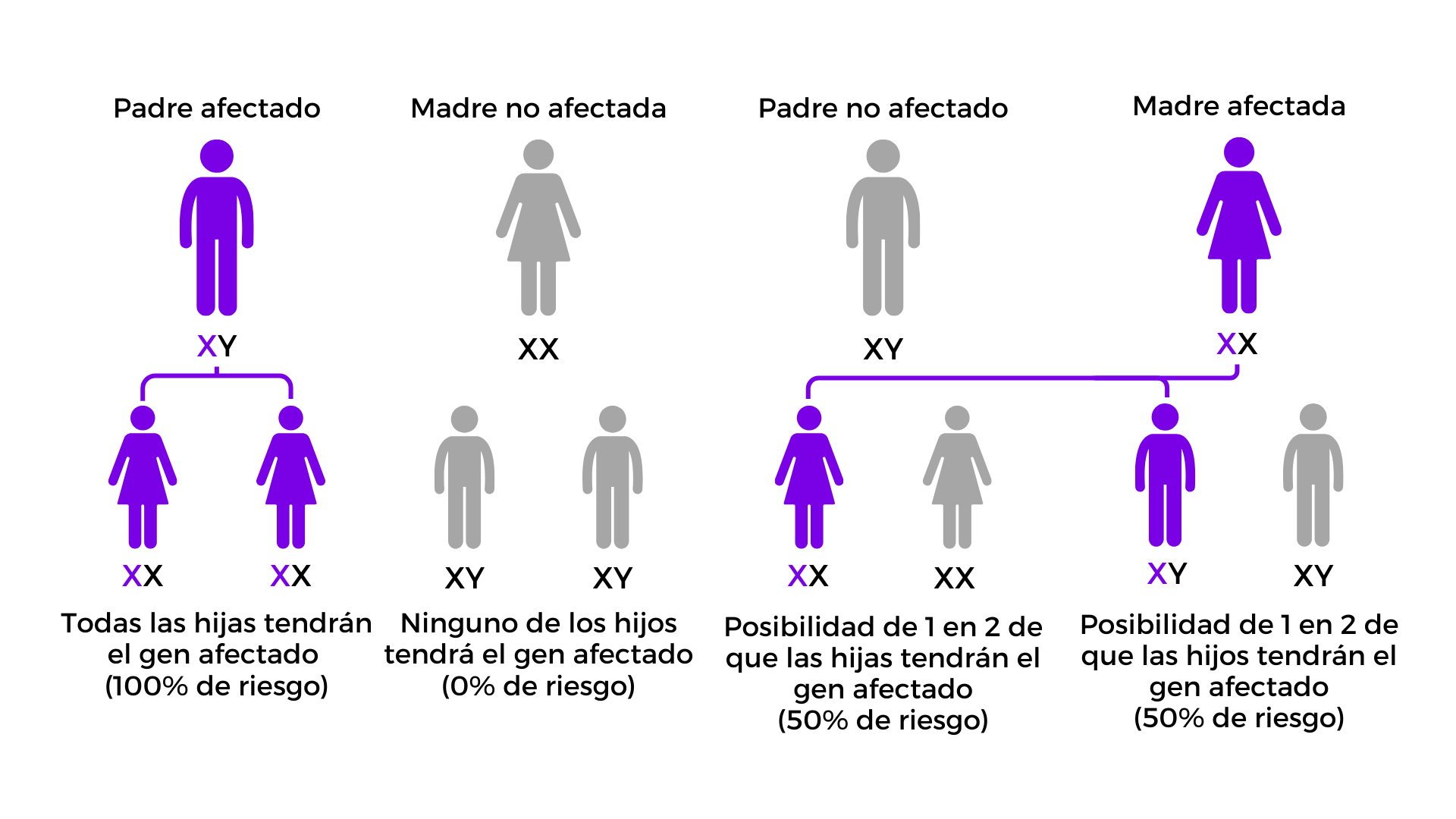
Descripción del patrón de herencia1-3
- La EF se hereda con un patrón ligado al cromosoma X, ya que el gen GLA está localizado en este cromosoma.
- Mujeres afectadas: suelen ser heterocigotas y tienen un 50% de probabilidad de transmitir la variante patogénica a cada hijo o hija.
- Hombres afectados: al ser hemicigotos, transmiten la variante al 100% de sus hijas y a ninguno de sus hijos.
- Expresión clínica según sexo:
- Varones (XY): al contar con un solo cromosoma X, la presencia de una variante patogénica del gen GLA genera un déficit enzimático más marcado y habitualmente se traduce en una forma clínica más grave.
- Mujeres (XX): el fenómeno de inactivación aleatoria del X (lionización) determina una expresión clínica variable.
Fenotipos y manifestaciones clínicas4-6
- La EF muestra una amplia variabilidad en su cuadro clínico, influida por el género, el genotipo y el nivel de déficit enzimático α-GALA.
- Fenotipo clásico:
- Inicio temprano, predominio pediátrico y en adolescentes.
- Déficit importante de actividad enzimática (<3% respecto al valor normal).
- Acroparestesias, síntomas gastrointestinales, angioqueratomas, hipohidrosis, intolerancia al calor y cornea verticilata.
- Desde la 2a a la 4a década de vida suelen presentar progresión a daño cardíaco, renal y cerebral.
- Fenotipo no clásico o tardío:
- Generalmente se manifiesta en la adultez.
- Mayor actividad enzimática residual (3-30% del valor normal).
- Compromiso predominante de un solo órgano, habitualmente corazón o riñón, con menor cantidad de síntomas sistémicos.
- Mujeres: Presentan una expresión clínica variable, desde asintomáticas hasta afectación grave, similar a los hombres, en función de la variante genética, el patrón de inactivación del cromosoma X (lionización) y de factores epigenéticos.
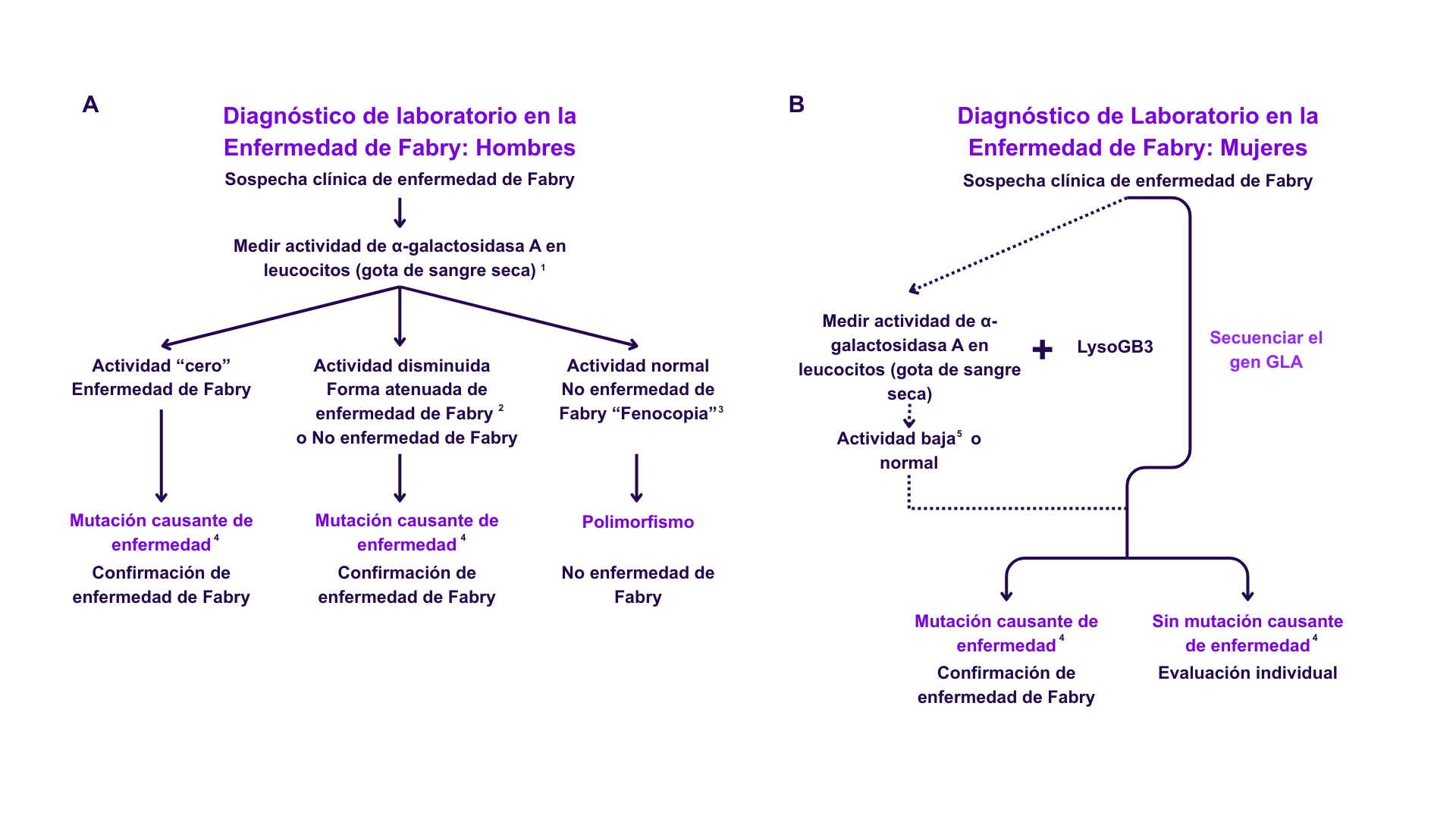
Metodologías diagnósticas1,2,6
El diagnóstico de la enfermedad de Fabry se basa en una combinación de criterios:
- Evaluación clínica:
- Historia familiar detallada
- Valoración de la sintomatología.
- Pruebas bioquímicas:
- Actividad enzimática: medición de α-GalA en sangre seca en papel de filtro (DBS), leucocitos y plasma.
- Biomarcador: Determinación de Lyso-Gb3 en plasma.
- Estudio molecular:
- Secuenciación del gen GLA para identificar variantes patogénicas causantes de la EF.
- Biopsia de tejido:
- En casos seleccionados, biopsias de piel, riñón o corazón pueden confirmar la acumulación de glicoesfingolípidos.
* Es importante señalar que hasta un 40% de las mujeres afectadas pueden mostrar niveles enzimáticos dentro del rango normal, debido a la inactivación aleatoria del cromosoma X; por ello, el estudio genético es esencial en la sospecha diagnóstica en mujeres.
Importancia del árbol familiar en la EF7
La evaluación familiar puede ayudar a encontrar los pacientes con EF en una etapa más temprana en el curso de su enfermedad.
El diagnóstico de cualquier paciente con EF debe ser seguido por un estudio genealógico completo en forma de análisis del árbol familiar y la realización de exámenes a los otros miembros de la familia que están en riesgo. Un árbol familiar es el primer paso para identificar a otros miembros de la familia con Fabry.
El estudio del árbol genealógico es fundamental en el manejo de la EF, pues permite identificar familiares en riesgo y ofrecerles diagnóstico precoz y tratamiento oportuno.
- Tras el diagnóstico de un caso índice, el análisis genealógico completo facilita la detección de individuos presintomáticos, quienes pueden ser diagnosticados y tratados a edades más tempranas.
- La construcción del árbol familiar ayuda a guiar la búsqueda activa de otros afectados, optimizando el manejo integral y familiar de la enfermedad.
- Este enfoque es especialmente útil en la identificación de mujeres portadoras o en riesgo, dada la heterogeneidad clínica y el riesgo de infradiagnóstico.
- El estudio familiar permite un abordaje proactivo, mejorando el pronóstico al reducir el tiempo al diagnóstico y favoreciendo decisiones clínicas más informadas.
Referencias
- Germain, D. P. (2010). Fabry disease. Orphanet Journal of Rare Diseases, 5(1), 30. https://doi.org/10.1186/1750-1172-5-30
- Ortiz, A., et al. (2018). Fabry disease revisited: Management and treatment recommendations for adult patients. Molecular Genetics and Metabolism, 123(4), 416–427. https://doi.org/10.1016/j.ymgme.2018.02.014
- Izhar, R., Borriello, M., La Russa, A., Di Paola, R., De, A., Capasso, G., Ingrosso, D., Perna, A. F., & Simeoni, M. (2024). Fabry Disease in Women: Genetic Basis, Available Biomarkers, and Clinical Manifestations. Genes, 15(1), 37. https://doi.org/10.3390/genes15010037
- Ortiz, A., Germain, D. P., Desnick, R. J., Politei, J., Mauer, M., Burlina, A., Eng, C., Hopkin, R. J., Lemay, R., Linhart, A., Pintos-Morell, G., Waldek, S., Wallace, E., Weidemann, F., Wilcox, W. R., & Warnock, D. G. (2018). Fabry disease revisited: Management and treatment recommendations for adult patients. Molecular Genetics and Metabolism, 123(4), 416–427. https://doi.org/10.1016/j.ymgme.2018.02.014
- Arends, M., Wanner, C., Hughes, D., Mehta, A., Oder, D., Watkinson, O. T., Elliott, P. M., Linthorst, G. E., Svarstad, E., Cecchi, F., et al. (2017). Characterization of classical and nonclassical Fabry disease: A multicenter study. Journal of the American Society of Nephrology, 28(5), 1631–1641. https://doi.org/10.1681/ASN.2016090964
- Echevarria, L., Benistan, K., Toussaint, A., Dubourg, O., Hagege, A. A., Eladari, D., Jabbour, F., Beldjord, C., De Mazancourt, P., & Bonneau, D. (2016). X-chromosome inactivation in female patients with Fabry disease. Clinical Genetics, 89(1), 44–54. https://doi.org/10.1111/cge.12613
MAT-CO-2503453
Este material está dirigido exclusivamente a Profesionales de la Salud, con el propósito de brindar información científica y educativa. Esta información tiene fines únicamente de intercambio científico y no representa una promoción. SANOFI no recomienda indicaciones que no estén contenidas en la información para prescribir aprobada de sus productos por la Autoridad Regulatoria Local. Sanofi-Aventis de Colombia S.A. - Transversal 23 N 97-23, Edificio City Business, Piso 8, Bogotá D.C.
Signos y síntomas
Cómo se vive y se sienten los signos & síntomas en la enfermedad de Fabry
El diagnóstico precoz de las enfermedades lisosomales es fundamental. Muchos de estossíntomas, frecuentes en la edad adulta, pueden aparecer durante la infancia.



.png)

.jpg/jcr:content/image%20(1).jpg)
.jpg/jcr:content/image%20(2).jpg)
.jpg0/jcr:content/image%20(3).jpg)
.jpg0/jcr:content/image%20(4).jpg)
.jpg1/jcr:content/image%20(5).jpg)
.jpg0/jcr:content/image%20(6).jpg)
.jpg0/jcr:content/image%20(9).jpg)
.jpg0/jcr:content/image%20(10).jpg)
.jpg0/jcr:content/image%20(11).jpg)
.jpg0/jcr:content/image%20(12).jpg)
.jpg0/jcr:content/image%20(1).jpg)
.jpg/jcr:content/image%20(6).jpg)
.jpg/jcr:content/image%20(7).jpg)