
Descubre la eficacia de Dupixent® en Asma Grave2
El asma grave representa una forma más severa de enfermedad respiratoria crónica que afecta significativamente la calidad de vida de los pacientes. A diferencia del asma leve o moderada que puede controlarse con medicamentos convencionales, el asma grave requiere tratamientos más intensivos y frecuentemente no logra un control adecuado a pesar de dosis altas de corticosteroides inhalados.
Esta condición se caracteriza por síntomas persistentes, exacerbaciones frecuentes y limitaciones importantes en las actividades diarias. La introducción de Dupixent® como tratamiento complementario ha demostrado resultados prometedores en el manejo del asma grave, especialmente en pacientes con inflamación tipo 2.
¿Qué diferencia al asma grave del asma leve o moderada?
El asma grave se define por la presencia de síntomas no controlados a pesar del tratamiento con dosis altas de corticosteroides inhalados más un segundo controlador.
Los pacientes experimentan síntomas diarios, despertares nocturnos frecuentes y exacerbaciones que requieren corticosteroides orales al menos dos veces al año.
A diferencia del asma leve donde los síntomas son intermitentes y se controlan con medicación de rescate ocasional, el asma grave presenta una obstrucción persistente del flujo aéreo. La función pulmonar permanece comprometida incluso con tratamiento óptimo, reflejándose en valores de VEF1 menores al 80% del predicho.
Tabla comparativa: Asma vs Asma Grave
|
Características |
Asma Leve/Moderada |
Asma Grave |
| Síntomas diurnos | ≤2 veces/semana a diarios |
Continuos, múltiples veces al día |
| Despertares nocturnos | Ocasionales a semanales | Frecuentes, casi diarios |
|
Uso de medicación de rescate |
≤2 veces/semana a diario | Varias veces al día |
| Limitación de actividades | Ninguna a alguna | Extremadamente limitadas |
| Función pulmonar (VEF1) | >80% del predicho | <60% del predicho |
| Exacerbaciones/año | 0-1 |
≥2 que requieren corticosteroides orales |
| Control con tratamiento estándar | Bueno a parcial | Pobre a pesar de dosis |
Dupixent® (dupilumab) es un anticuerpo monoclonal totalmente humano que bloquea la señalización de las interleucinas 4 y 13 (IL-4 e IL-13). Estas citocinas desempeñan un papel central en la inflamación tipo 2, presente en aproximadamente el 50-70% de los pacientes con asma grave.
El medicamento se administra mediante inyección subcutánea cada dos semanas como tratamiento de mantenimiento complementario. No es un corticosteroide ni un inmunosupresor de amplio espectro, sino un biológico dirigido específicamente a la cascada inflamatoria tipo 2.
En el asma eosinofílica y el asma dependiente de corticosteroides orales, Dupixent® actúa reduciendo la inflamación de las vías respiratorias. Al bloquear IL-4 e IL-13, disminuye la producción de IgE, la infiltración eosinofílica y la hiperreactividad bronquial característica del asma grave.
Eficacia clínica demostrada en asma grave
Los estudios clínicos con más de 2,800 pacientes han demostrado que Dupixent® reduce las exacerbaciones graves hasta en un 81% en pacientes con recuentos elevados de eosinófilos. Esta reducción significativa se traduce en menos hospitalizaciones, visitas a urgencias y necesidad de corticosteroides orales.
La función pulmonar mejora notablemente con Dupixent®, observándose incrementos en el VEF1 desde las dos primeras semanas de tratamiento. Los pacientes experimentan una mejoría sostenida que se mantiene durante todo el período de tratamiento, con aumentos promedio de 320-430 mL en el VEF1.
En pacientes dependientes de corticosteroides orales, Dupixent® permitió que el 48% redujera su dosis en al menos un 50%. Además, el 18% de los pacientes logró eliminar completamente el uso de corticosteroides orales manteniendo el control del asma.
Los beneficios se extienden más allá de los parámetros espirométricos. Los pacientes reportan mejoras significativas en los cuestionarios de control del asma (ACQ) y calidad de vida relacionada con el asma (AQLQ), reflejando un impacto positivo integral.
Mejora en la calidad de vida con Dupixent®
El tratamiento con Dupixent® permite a los pacientes recuperar actividades que el asma grave había limitado severamente. La reducción de síntomas diurnos y nocturnos se traduce en mejor calidad del sueño, menos fatiga y mayor capacidad para realizar actividades físicas.
Los pacientes tratados reportan una disminución significativa en el uso de medicación de rescate y menor ansiedad relacionada con los ataques de asma. Esta mejora en el control permite una planificación más confiable de actividades laborales, sociales y recreativas.
La reducción en las exacerbaciones graves significa menos interrupciones en la vida cotidiana por hospitalizaciones o visitas a urgencias. Los pacientes experimentan una sensación de mayor control sobre su enfermedad, lo que impacta positivamente en su bienestar emocional.
El perfil de seguridad de Dupixent® es favorable, siendo las reacciones en el sitio de inyección el efecto adverso más común. La mayoría de los pacientes toleran bien el tratamiento, permitiendo su uso a largo plazo para mantener los beneficios alcanzados.
Candidatos ideales para el tratamiento
Dupixent® está indicado para pacientes de 6 años o más con asma eosinofílica o asma dependiente de esteroides orales moderada a grave no controlada. Los mejores candidatos son aquellos con recuentos de eosinófilos en sangre ≥150 células/μL y evidencia de inflamación tipo 2.
Los pacientes que experimentan exacerbaciones frecuentes a pesar del tratamiento óptimo con corticosteroides inhalados de dosis alta más LABA son candidatos prioritarios. También aquellos que requieren corticosteroides orales de mantenimiento o cursos frecuentes para mantener el control.
La evaluación debe incluir confirmación del diagnóstico de asma, optimización del tratamiento actual y evaluación de la adherencia antes de iniciar Dupixent®. El fenotipado del asma mediante biomarcadores ayuda a identificar a los pacientes con mayor probabilidad de respuesta.
Consideraciones importantes del tratamiento
Dupixent® debe utilizarse como tratamiento complementario, no sustituyendo los medicamentos controladores actuales del paciente. Los corticosteroides inhalados y otros controladores deben continuarse según las indicaciones médicas.
No es un medicamento de rescate y no debe utilizarse para tratar síntomas agudos o exacerbaciones. Los pacientes deben mantener disponible su medicación de rescate habitual para el manejo de síntomas repentinos.
El monitoreo regular permite evaluar la respuesta al tratamiento y ajustar otros medicamentos según la mejoría observada. La reducción de corticosteroides orales debe realizarse gradualmente bajo supervisión médica para evitar insuficiencia suprarrenal.
La educación del paciente sobre la técnica correcta de inyección y el manejo de posibles efectos adversos es fundamental. El programa de apoyo DUPIXENT MyWay® ofrece recursos y asistencia para optimizar la experiencia del tratamiento.
Fuentes de referencia:
- DUPIXENT® (dupilumab). Información de prescripción. Sanofi-Aventis U.S. LLC y Regeneron Pharmaceuticals, Inc. Disponible en: https://www.dupixent.com/es/
- Castro M, Corren J, Pavord ID, et al. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma. N Engl J Med. 2018;378(26):2486-2496.
- Rabe KF, Nair P, Brusselle G, et al. Efficacy and Safety of Dupilumab in Glucocorticoid-Dependent Severe Asthma. N Engl J Med. 2018;378(26):2475-2485.
Es el momento de abordar todo el espectro de la Inflamación Tipo2 en el Asma Grave
La inflamación de tipo 2 engloba diversos fenotipos del asma1:

Hasta el 82% de los pacientes mayores de 12 años con asma tienen inflamación tipo 21
Los biomarcadores de inflamación tipo 2 (EOS en sangre, EOS en esputo, y FeNO) pueden suprimirse con el uso de corticoesteroides sistémicos. Esto se debe tener en cuenta a la hora de determinar el grado de inflamación de tipo 2 en los pacientes que toman corticoesteroides orales2 .
Se define como impulsada por 1 de 3 fenotipos: eosinófilo (EOS ≥ 150 células / μL), atópico (lgE ≥ 0,35 UI / ml) o asma con niveles elevados de Th2 (lgE ≥ 100 UI / mL +EOS ≥ 140 células / μL).
IL-4 e IL-3 son las citocinas clave y centrales de la inflamación tipo 22
La inflamación tipo 2 desempeña un papel importante en el asma grave no controlada, lo que contribuye a un aumento de las exacerbaciones y a una disminución de la función pulmonar2,3,4
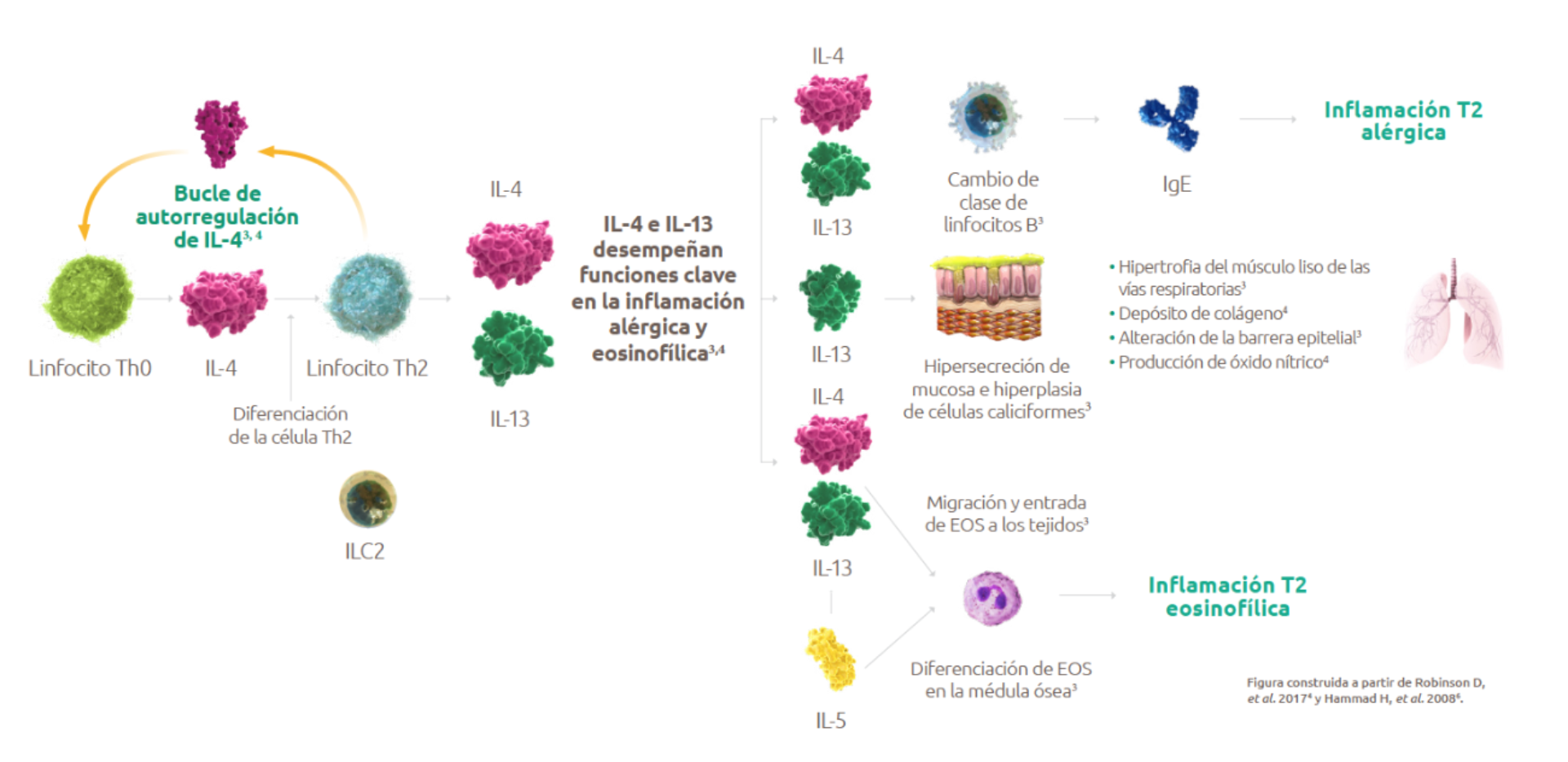
EOS: eosinófilos; IgE: inmunoglobulina E; IL: interleucina; ILC2: células linfoides innatas de tipo 2.
Dupixent es el primer único biológico que inhibe la señalización de IL-4 e IL-132
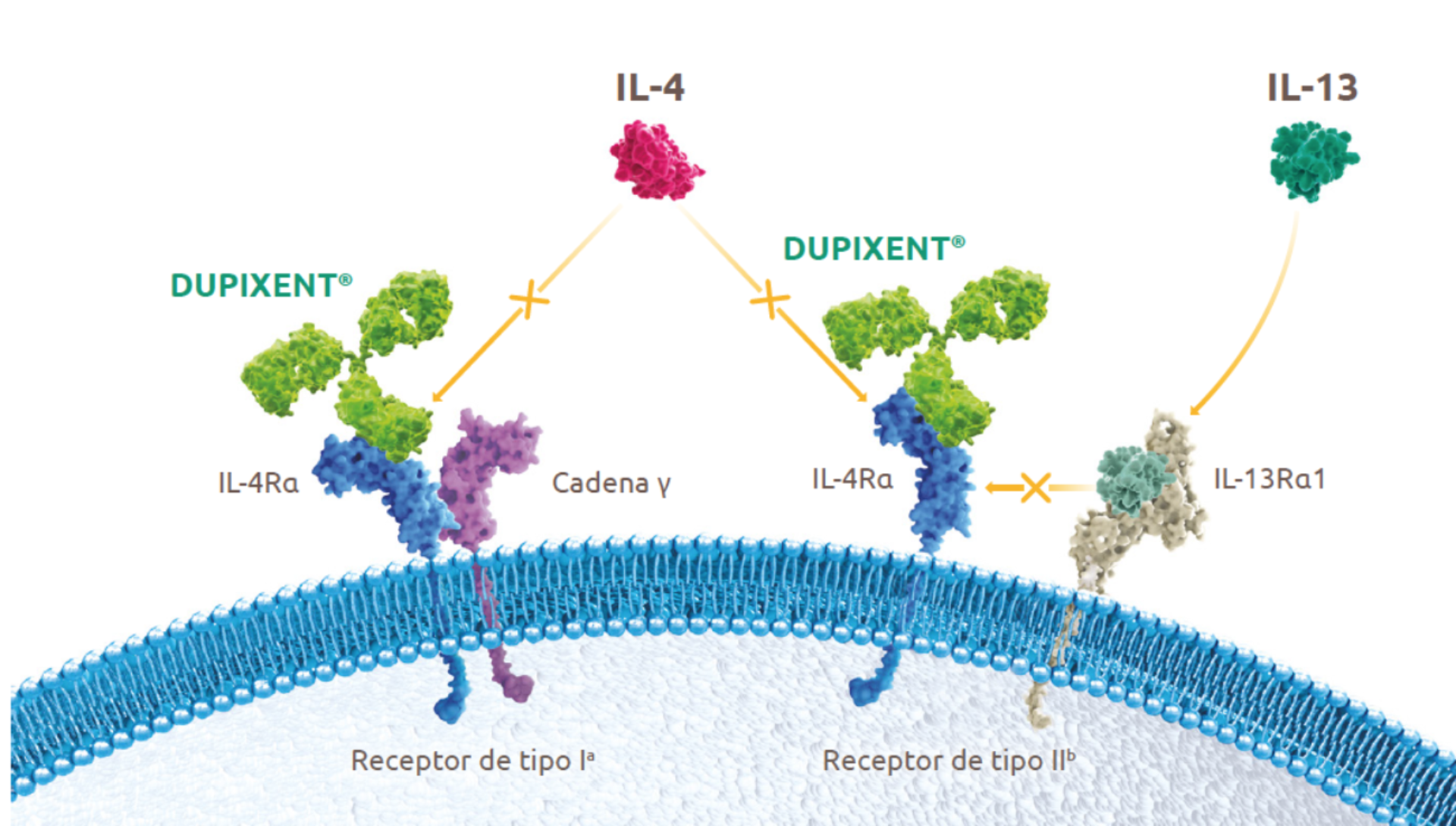
Dupixent® es un anticuerpo monoclonal completamente humano que bloquea la señalización de IL-4 a través del receptos de tipo I (IL-4Ra / yc), así como la señalización de IL-4 y IL-13 a través del receptor del tipo II (IL-4Ra / IL-13ra)2.
Mecanismo de acción
Dupixent® bloquea los efectos provocados por IL-4 e IL-13 y, como consecuencia, reduce:
| La inflamaci6n pulmonar eosinofilica, pese a la presencia de EOS en sangre2 | |
| Los niveles de FeNO, marcador de IL-13 y relacionado con la inflamaci6n pulmonar5 | |
| La cantidad de lgE total y específica frente a alérgenos perennes 2 |
Eficacia demostrada en un amplio espectro
Eficacia demostrada en un amplio espectro de fenotipos de Asma Grave no controlada con inflamaci6n Tipo 2. Evaluada en un programa clínico con 3.000 pacientes2
Hasta un 69% de reducción de exacerbaciones Reducción significativa de las exacerbaciones graves anualizadas en la semana 52 en pacientes con FeNO ≥25 ppb con DUPIXENT® 200 mg frente a placebo (0,40 vs. 1,30; p <O,OO1) en pacientes que recibían ICS en dosis altas6
Hasta un 86% de los pacientes redujeron un ≥50% el uso de OCS en la semana 24 Reducción o eliminación de la dosis de OCS en la semana 24 en pacientes corticodependientes con FeNO ≥25 ppb con DUPIXENT® 300mg vs. 51% con placebo2
Hasta 480ml de mejora de la función pulmonar a las 52 semanas, medida por FEV1 Mejora rápida y sostenida de la función pulmonar desde el inicio hasta la semana 52 en pacientes con EOS ≥300 células/μL DUPIXENT® 300 mg vs. 230ml con placebo.7
Hasta un 76% de mejora significativa de control del asma y la calidad de vida Alta tasa de respondedores ACQ-5 en la semana 52 en las medidas informadas por los pacientes de sueño, limitaciones de actividad y respiración en pacientes con FeNO ≥25ppb con DUPIXENT® 300 mg VS. 64% con placebo.2,8
Se observaron mayores mejorias en los pacientes con niveles elevados de biomarcadores de inflamaci6n de tipo 25
Dupixent®: el biológico para el abordaje completo de la inflamación de Tipo 22
- Tratamiento con dosis altas de ICS/LABA + LAMA
- Antecedentes de alergías (ácaros del polvo y gatos)
| Niveles de EOS en sangre |
158 céls./µl |
| lgE total | 710 UI/ml |
| Valor basal de FeNOt | 35 ppb |
| Función pulmonar | 70% FEV1 |
| Exacerbaciones anuales | 2 |
- Tratamiento con dosis altas de ICS/LABA + LAMA
| Niveles de EOS en sangre |
560 céls./µl |
| lgE total | 25 UI/ml |
| Valor basal de FeNOt | 21 ppb |
| Función pulmonar | 60% FEV1 |
| Exacerbaciones anuales | 2 |
- Tratamiento con dosis altas de ICS/LABA + LAMA
- Antecedentes de alergías: ácaros del polvo doméstico, gatos y Alternaria
| Niveles de EOS en sangre |
360 céls./µl |
| lgE total | 147 UI/ml |
| Valor basal de FeNOt | 60 ppb |
| Función pulmonar | 60% FEV1 |
| Exacerbaciones anuales | >2 |
- Tratamiento con dosis altas de ICS/LABA + LAMA y uso diario de OCS (12mg/día)
| Niveles de EOS en sangre |
200céls./µl |
| lgE total | 140 UI/ml |
| Valor basal de FeNOt | 23 ppb |
| Función pulmonar | 55% FEV1 |
| Exacerbaciones anuales | ≥2 |
- Tratamiento con dosis altas de ICS/LABA
- Ansiedad y problemas de sueño
- Problemas de concentración escolar
| Niveles de EOS en sangre |
350 céls./µl |
| lgE total | 180 UI/ml |
| Valor basal de FeNOt | 17 ppb |
| Función pulmonar | 50% FEV1 |
| Exacerbaciones anuales | 2 |
Los perfiles de pacientes son hipotéticos y no son pacientes reales tratados con DUPIXENT®
EOS: eosinófilos; FeNO: fracción exhalada de óxido nítrico; FEVI: volumen espiratorio forzado en 1 segundo; IC: intervalo de confianza; lg: inmunoglobulina; INCS: corticosteroides inhalados; LABA: agonista ß2 adrenérgico de acci6n larga; MMC: media de minimos cuadrados.; OCS: corticosteroides orales; RSCcPN: rinosinusitis cr6nica con poliposis nasal.
Perfil de seguridad establecido a largo plazo2,9
DUPIXENT® es un anticuerpo monoclonal completamente humano2
Perfil de seguridad demostrado en más de 10.000 pacientes de ensayos clinicos que abarcan múltiples grupos de edad en distintas indicaciones como dermatitis atópica, asma y RSCcPN$2
Lista de reacciones adversas:
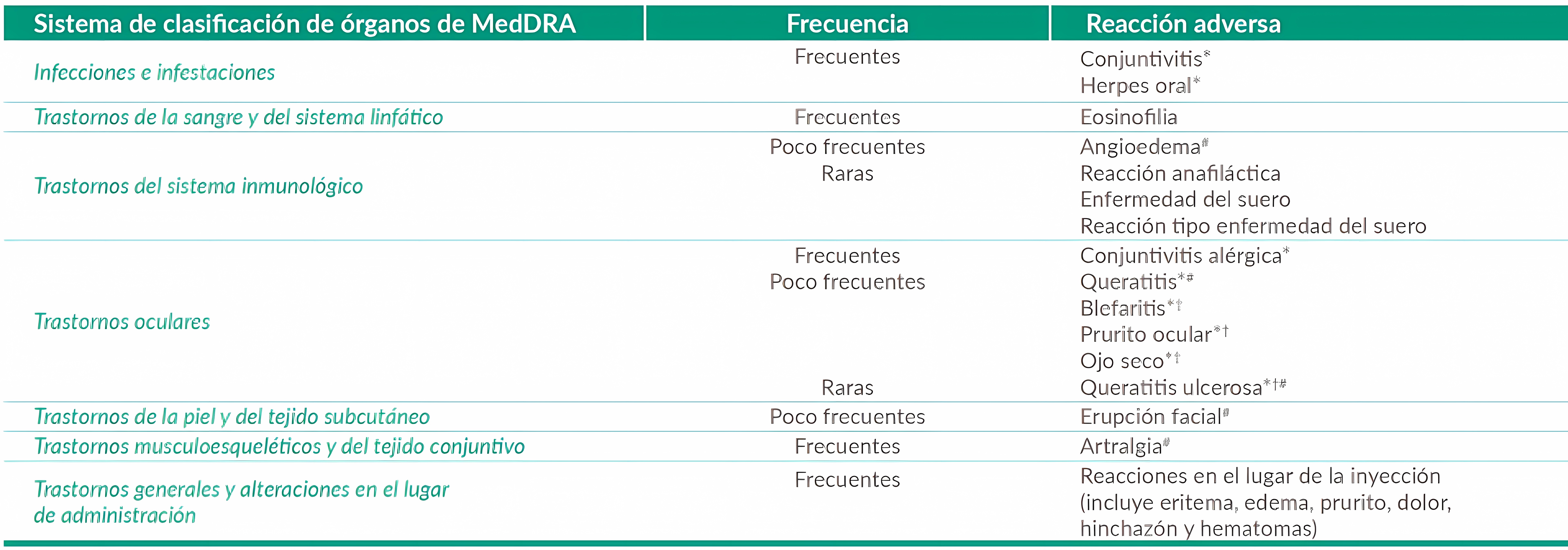
*Los trastornos oculares y el herpes oral se produjeron predominantemente en los estudios de dermatitis atópica. Las frecuencias para prurito ocular, blefaritis y ojo seco fueron frecuentes y la queratitis ulcerosa fue poco frecuente en los estudios de dermatitis atópica. A partir de informes de poscomercialización.
En Ia tabla se enumeran Ias reacciones adversas observadas en los ensayos clinicos y/o ámbito poscomercialización según Ia clasificación por Organos y sistemas y frecuencia, utilizando las siguientes categorias: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1.000 a <1/100), raras (≥1/10.000 a <1/1.000), muy raras (<1/10.000). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad.
Tabla extraida de ficha de Dupixent
El perfil de seguridad de DUPIXENT® a las 96 semanas fue consistente con el perfil de seguridad observado en estudios2 pivotales de asma de hasta 52 semanas de tratamiento
Contenido mínimo de Dupixent
CONSULTE FICHA TÉCNICA COMPLETA ANTES DE PREESCRIBIR ESTE MEDICAMENTO.
Referencias
-
Tran TN, Zeiger RS, Peters SP, et al. Overlap of atopic, eosinophilic, and TH2-high asthma phenotypes in a general population with current asthma. Ann Allergy Asthma Immunol. 2016;116(1):37-42.
-
CIMA - Centro de información online de medicamentos de la AEMPS. Dupixent® (dupilumab). Ficha Técnica [en línea] [consulta: 7 de mayo de 2024]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1171229006/FT_1171229006.html
-
Robinson D, Humbert M, Buhl R, et al. Revisiting type 2-high and type 2-low airway inflammation in asthma: current knowledge and therapeutic implications. Clin Exp Allergy. 2017;47(2):161-175.
-
Hammad H, Lambrecht BN. Dendritic cells and epithelial cells: linking innate and adaptive immunity in asthma. Nat Rev Immunol. 2008;8(3):193-204.
-
Castro M, Corren J, Pavord ID, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018;378(26):2486-2496.
-
Pavord ID, Deniz Y, Corren J, Casale TB, FitzGerald JM, Izuhara K, Daizadeh N, Ortiz B, Johnson RR, Harel S, Djandji M, Goga L, Crikelair N, Rowe PJ, Busse WW. Baseline FeNO Independently Predicts the Dupilumab Response in Patients With Moderate-to-Severe Asthma. J Allergy Clin Immunol Pract. 2023 Apr;11(4):1213-1220.e2. doi: 10.1016/j.jaip.2022.11.043. Epub 2022 Dec 16. PMID: 36535524.
-
Castro M, Rabe KF, Corren J, et al. Dupilumab improves lung function in patients with uncontrolled, moderate-to-severe asthma. ERJ Open Res. 2020;6(1):00204-2019. (Suppl. material).
-
Meltzer EO, Busse WW, Wenzel SE, et al. Use of the Asthma Control Questionnaire to predict future risk of asthma exacerbation. J Allergy Clin Immunol. 2011;127(1):167-172.
-
Wechsler ME, Ford LB, Maspero JF, et al. Long-term safety and efficacy of dupilumab in patients with moderate-to-severe asthma (TRAVERSE): an open-label extension study. Lancet Respir Med. 2021. Sep 28;S2213-2600(21)00322-2. doi: 10.1016/S2213-2600(21)00322-2. Online ahead of print.





