Apresentação clínica e progressão da doença
Manifestações comuns da LOPD
Manifestações comuns da doença de Pompe de Início Tardio (LOPD)
Apesar das manifestações da doença de Pompe serem multissistémicas, os doentes com LOPD apresentam mais frequentemente sinais de envolvimento motor e respiratório1-3
O envolvimento respiratório é um sinal importante de dano muscular na doença dePompe que é frequentemente mascarado pela perda de mobilidade4
Sinais de envolvimento muscular motor e respiratório
| Músculos proximais e da cintura pélvica | Músculos respiratórios |
|
|
LOPD em movimento
Doentes que vivem com LOPD podem experienciar desafios numa variedade de tarefas diárias, desde subir escadas até levantar-se de uma cadeira, ou ainda chegar a objetos acima do nível da cabeça.1,5,9Utilizando uma tecnologia de captura de movimento, os vídeos animados abaixo mostram doentes com vários graus de gravidade da doença a realizarem estas tarefas diárias.
Manifestações da LOPD e da IOPD
LOPD
A LOPD pode ser diagnosticada quer em crianças, quer em adultos. A LOPD progride geralmente mais lentamente que a IOPD. Ao contrário da IOPD, doentes com LOPD têm pouco ou nenhum envolvimento cardíaco. Contudo, a doença de Pompe é sempre progressiva e está associada a morbilidade significativa e/ou a morte prematura.1
Doentes com LOPD apresentam uma grande variabilidade. As manifestações clínicas mais comuns são fraqueza muscular progressiva, principalmente dos músculos proximais, e insuficiência respiratória, culminado finalmente em perda de deambulação e marcha e na necessidade de suporte ventilatório.1,10,11
Manifestações da doença em doentes com LOPD
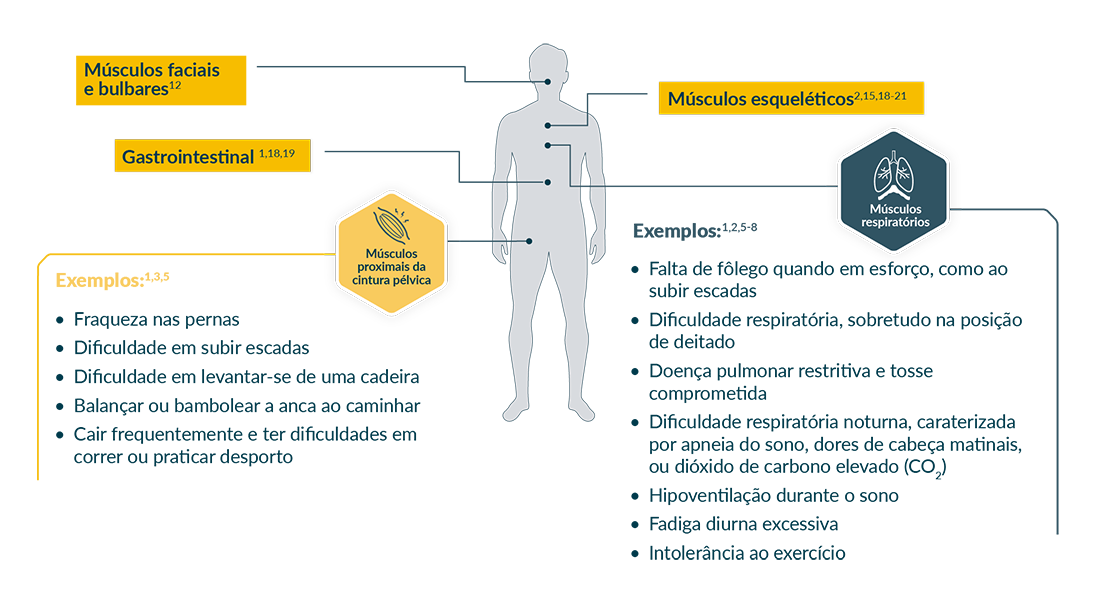
Músculos faciais e buIbares12
- Dificuldade em falar
- Dificuldade em engolir
- Fraqueza muscular facial (ptose, por exemplo)
Gastrointestinal1,18,19
- Perda de peso inexplicável
- Incontinência fecal/urinária de urgência
- Sintomas de angústia gastrointestinal
Músculos esqueléticos1,12-17
- Escoliose
- Osteoporose
- Osteopenia
- Fraturas vertebrais
- Hipercalemia persistente inexplicada (1,5 a 15x níveis normais; —300-2000 U/L)
IOPD
Doentes com IOPD apresentam tipicamente hipotonia pronunciada e cardiomegalia grave. Outros sinais incluem infeções respiratórias frequentes, falha no atingimento de marcos motores e dificuldade de alimentação.1
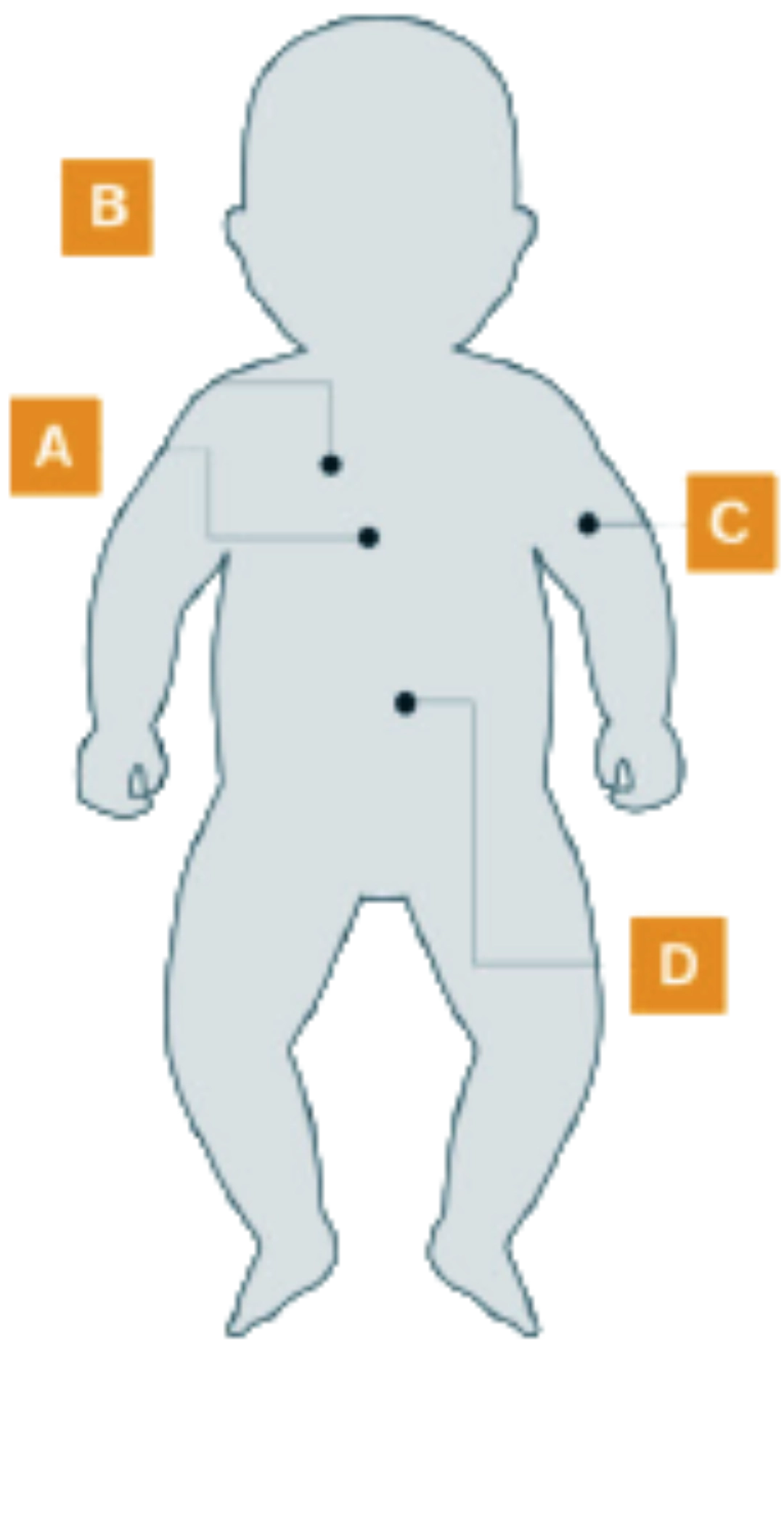
Manifestações da doença em doentes com IOPD
[A]
Cardíacas10
- Cardiomegalia
- Cardiomiopatia progressiva
[B]
Respiratórias1,10
- Envolvimento progressivo dos músculos respiratórios
- Infeções respiratórias frequentes
- Respiração irregular durante o sono
[C]
Musculoesqueléticas10
- Fraqueza muscular progressiva
- Hipotonia profunda / incapacidade de sustentar o peso da cabeça / “floppy baby”
- Atraso nos marcos motores
[D]
Gastrointestinais10
- Macroglossia
- Dificuldades na alimentação
- Fraco desenvolvimento / pouco ganho de peso
- Hepatomegalia
Teste atempadamente para a doença de Pompe se se deparar com estes sinais e sintomas comuns na sua prática clínica13
A acumulação progressiva de glicogénio e os danos musculares contínuos podem resultar em variadas manifestações debilitantes e que têm o potencial de colocar em risco a vida.1,10,13
Qualidade de vida
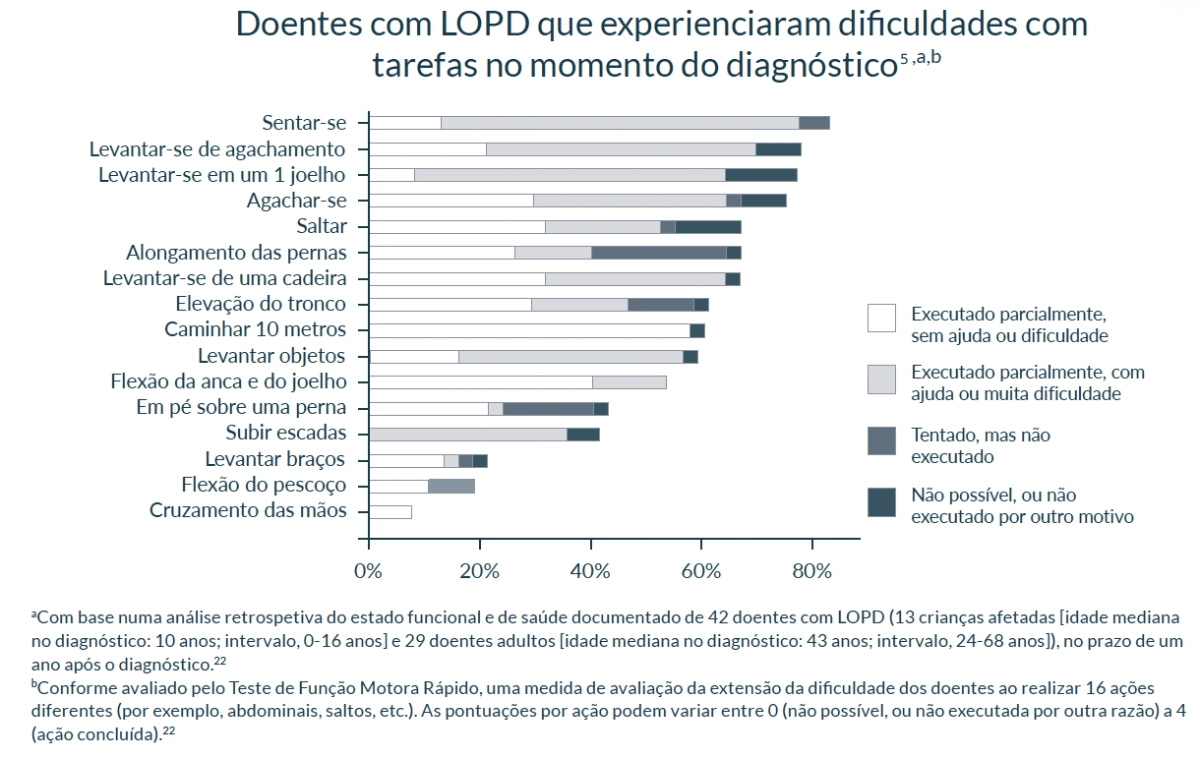
Pela altura do diagnóstico, 80% dos doentes com LOPD referem experienciar problemas com tarefas do quotidiano, devido à perda de força e função musculares5,a
Em doentes com LOPD, a perda progressiva e continuada da função muscular pode conduzir a consequências limitadoras da vida. Pela altura do diagnóstico5,a
- 50% dos doentes tem dificuldade em levantar-se de uma cadeira5
- Quase 50% dos doentes experienciam limitações na sua capacidade para trabalhar ou estudar5
- Mais de 20% dos doentes usam cadeira de rodas e/ou necessitam de suporte ventilatório5
Proporção de doentes com LOPD que experienciam dificuldades em realizar tarefas pela altura do diagnóstico5,a,b
Num estudo observacional de 12 meses de doentes com LOPD que realizaram o teste dos 6 minutos de marcha (6MWT - 6-minute walk test), houve uma diferença de quase 150 metros na resistência funcional, entre os seguintes grupos de doentes: 20
aCom base numa análise retrospetiva do estado funcional e de saúde documentado de 42 doentes com LOPD (13 crianças afetadas [idade mediana no diagnóstico: 10 anos; intervalo, 0-16 anos] e 29 doentes adultos [idade mediana no diagnóstico: 43 anos; intervalo, 24-68 anos]), no prazo de um ano após o diagnóstico.5
bConforme avaliado pelo Teste de Função Motora Rápido, uma medida de avaliação da extensão da dificuldade dos doentes ao realizar 16 ações diferentes (por exemplo, abdominais, saltos, etc.). As pontuações por ação podem variar entre 0 (não possível, ou não executada por outra razão) a 4 (ação concluída).5
À medida que a LOPD progride, os doentes podem perder a sua independência e mobilidade e necessitar de utilizar dispositivos de assistência20
Falência respiratória
Na LOPD, o declínio respiratório e a ameaça de falência respiratória necessitam de um diagnóstico atempado e de uma monitorização ativa.1,11,21,22
Modelo da progressão do declínio respiratório, medido pela capacidade vital forçada (CVF), em doentes com LOPD não tratados23,c
Modelo da progressão do declínio respiratório, medido pela capacidade vital forçada (CVF), em doentes com LOPD não tratados23,c
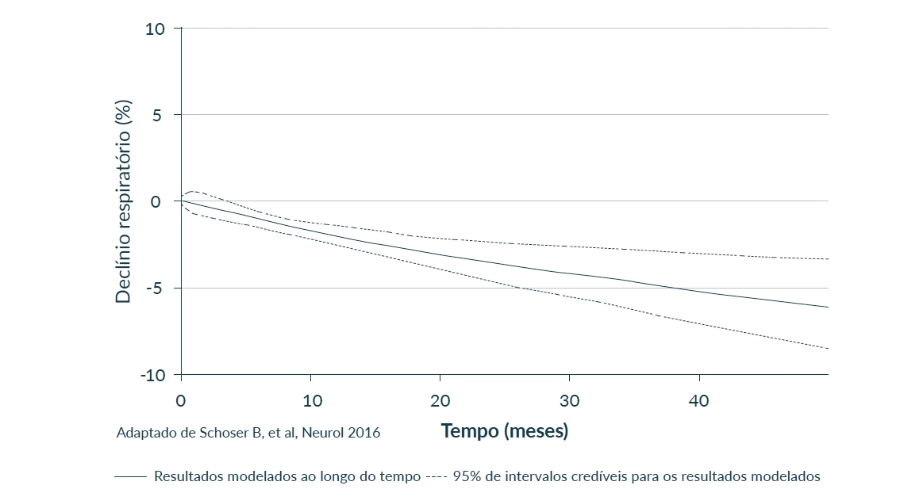
A função respiratória média, medida pela CVF, no início do estudo foi 61%, refletindo doença pulmonar restritiva moderada23,c
A função respiratória teve um declínio consistente, incluindo declínios de 2,3% após 12 meses e 6,2% após 48 meses.23
cCom base numa meta-análise de 19 estudos de doentes com LOPD. Os resultados contínuos foram modelados através de uma meta-análise polinomial fracionária que calcula o desenvolvimento de resultados ao longo do tempo.23
Na IOPD a falência cardiorespiratória é a causa primária de morte prematura10,24
A apresentação dos sintomas surge na primeira infância e estes progridem rapidamente, habitualmente culminando em morte pelos 2 anos de idade.10,24
A falência respiratória é a causa principal de morte em doentes com LOPD11
O declínio contínuo na função respiratória pode ocorrer sem tratamento, pelo que é necessária uma monitorização da doença de forma atempada e ativa. O envolvimento respiratório pode surgir precocemente, mesmo antes dos doentes apresentarem envolvimento da função motora.1,11,21-23
Caso clínico: doente com LOPD
Tem doentes na sua prática clínica com insuficiência respiratória de causa desconhecida? Explore um caso clínico num doente adulto
Resultados dos testes de diagnóstico
Resultados dos testes de diagnóstico
- Teste da gota de sangue seco (BDS, dried blood spot), nível da atividade enzimática da α-glucosidase ácida: <0,1 L (intervalo normal: 0,3-3,0)25
Intervenções terapêuticas
- Ventilação de dois níveis no modo de tempo espontâneo25
- Aguarda o início de terapêutica específica para a doença25
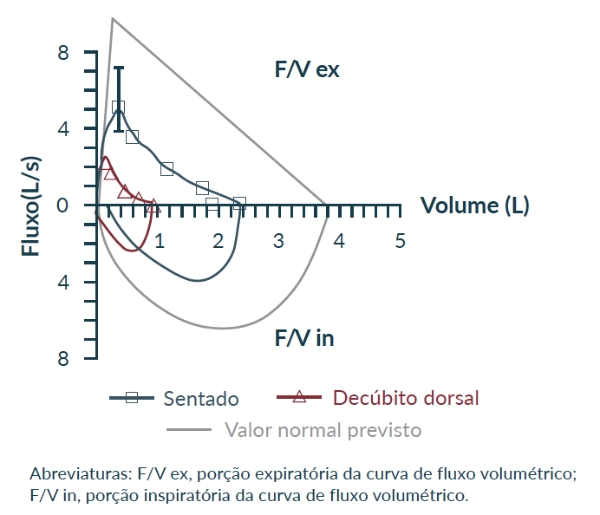
Avaliações da CVF nas posições sentada e supina25,29
Referências
- Kishnani PS, et al; ACMG Work Group on Management of Pompe Disease. Genet Med. 2006;8(5):267-288. doi:10.1097/01.gim.0000218152.8743413.
- Schuller A, et al. Am J Med Genet C Semin Med Genet 2012;160C(1):80-88. doi:10.1002/ajmg.c.31322.
- van Capelle CI, et al. Orphanet J Rare Din. 2016;11(1):65. doi:10.1186/s13023-016-0442-y.
- Cupler EJ, et al; AANEM Consensus Committee on Late-Onset Pompe Disease. Muscle Nerve. 2012;45(3):319-333. doi:10.1002/mus.22329.
- Rigter T, et al. Mol Genet Metab. 2012;107(3):448-455. doi:0.1016/Lymgme.2012.09.017.
- Mellles U, et al. Respir Med. 2009;103(4):477-484. doi:10.1016/j.rmed.2008.12.009.
- Boentert NI, et al. Intl Mol Sci. 2016;17(10):1735. doi:10.3390/ijms17101735.
- Fuller DD, et al. Respir Physiol Neurobiot 2013;189(2):241-249. doi:10.1016/Lresp.2013.06.007.
- van der Ploeg AT, et al. Eur Neurol. 2017;24(6):768-e31. doi:10.1111/ene.13285.
- Kishnani PS, et al. J Pediatr. 2004;144(5 suppl):S35-S43.
- Winkel LPF, et al. J Neural. 2005;252(80):875-884. doi:10.1007/s00415-005-0922-9.
- Chan J, et al. Mol Genet Metab. 2017;120(3):163-172. doi:10.1016/j.ymgme.2016.12.004.
- American Association of Neuromuscular and Electrodiagnostic Medicine. Muscle Nerve. 2009;40(1):149-160. doi:10.1002/mus.21393.
- Toscano A, et aI. Acta Myol. 2013;32(2):78-81.
- Preisler N, et al. Mol Genet Metab. 2013;110(3):287-289. dok10.1016/Lymgme.2013.08.005.
- Manganelli F, et al. Acta Myol. 2013;32(2):82-84.
- Moghadam-Kia S, et al. Cleve Clin 1 Med. 2016;83(1):37-42. doi:10.3949/ccjm.83a.14120.
- Karabul N, et al. JIMD Rep. 2014;17:53-61. doi:10.1007/8904_2014_334.
- Bernstein DL, et al. Mot Genet Metab. 2010;101(2-3):130-133. doh 10.1016aymgme.2010.06.003.
- Wokke JHJ, et al. Muscle Nerve. 2008;38(4):1236-1245. doi:10.1002/mus.21025.
- Alejaldre A, et al. Neuromuscul Disord. 2012;22(suppl 2):5148-S154. doi:10.1016/j.nmd.2012.05.011.
- Chien YH, et al. J Pediatr. 2011;158(6):1024-1027.e1. doi:10.1016/j.jpeds.2010.11.053.
- Schoser B, et al. J Neurol. 2017;264(4):621-630. doi:10.1007/s00415-016-8219-8.
- Kishnani PS, et al; Infantile-Onset Pompe Disease Natural History Study Group. J Pediatr. 2006;148(5):671-676. doi:10.1016/jjpeds.2005.11.033.
- O'Callaghan C, et al. Respirol Case Rep. 2016;4(5):e00178. doi:10.1002/rcr2.178.
- Johns MW. Sleep. 1991;14(6):540-545.
- Messina Z, et al. StatPearls. Treasure Island, FL: StatPearls Publishing; 2020. https://www.ncblnim.nih.goy/books/N BK551648/. Updated November 21, 2019. Accessed December 15, 2020.
- Ortiz-Prado E, et al. Am J Blood Res. 2019;9(1):1-14.
- Wood KL. Merck Manual Professional Version website. https://www.merckmanuals.com/professionaVpulmonary-disorders/tests-of-pulmonary-function-pfUairflow,-lung-yolumes,-and-flow-yolume-loop. Updated April 2020. Accessed December 15,2020.

















