Neuroinflamação
A biologia subjacente à neuroinflamação
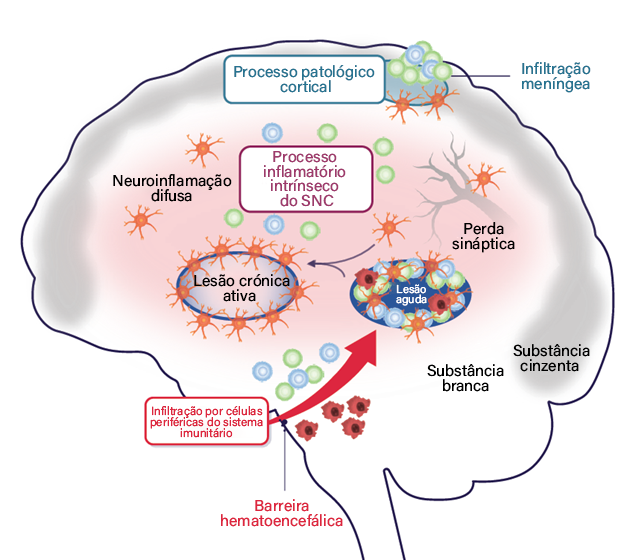




Processo patológico cortical
A patologia cortical é caracterizada pelo aumento de infiltrados meníngeos no espaço subaracnoideu. A patologia cortical contribui para a desmielinização e progressão da EM.
Processo inflamatório intrínseco do SNC
A inflamação intrínseca do SNC é perpetuada por processos que podem ou não estar associados a lesões. Estes processos incluem a presença de lesões crónicas ativas e desmielinização, neuroinflamação difusa, perda sináptica, gliose, lesão neuroaxonal e inflamação crónica/smoldering associada a neurodegeneração.
Infiltração por células periféricas do sistema imunitário
Este processo é caracterizado pela migração de células do sistema imunitário adaptativo (linfócitos B e T) e de macrófagos para o SNC.
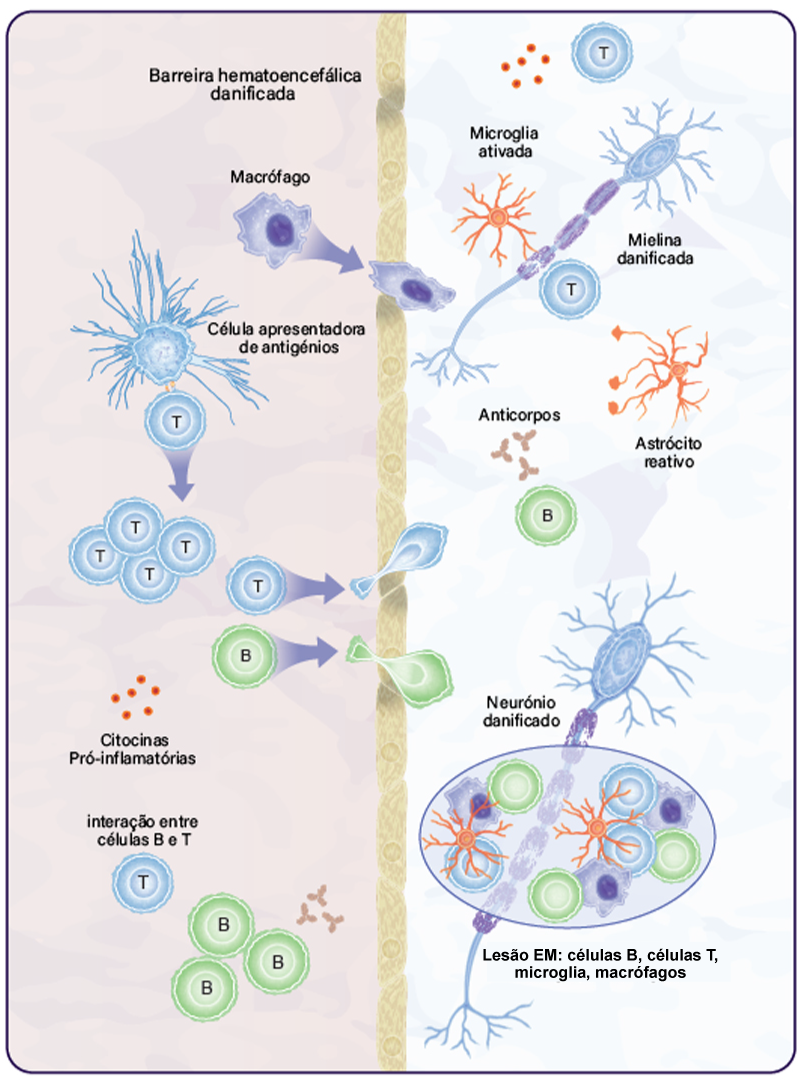
Intervenientes na neuroinflamação
.png)
Sistema Imunitário Inato
Periferia
Macrófagos/ Células Dendríticas
- Células apresentadoras de antigénios para ativar as células T5
- Em doentes com EM, apresentam um fenótipo ativado e produzem níveis elevados de citocinas pró-inflamatórias, contribuindo para a inflamação5,6
Sistema Nervoso Central
Microglia / Macrófagos
- Células predominantes em lesões crónicas e ativas, persistem na EM secundária progressiva e contribuem para a neurodegeneração crónica.5
- Ativadas por citocinas/quimiocinas libertadas por linfócitos e células inflamatórias e interagem com oligodendrócitos e neurónios em apoptose.6,7
- A microglia ativada pode ser encontrada na substância branca e cinzenta.5
- Contribuem para a desmielinização e a libertação de produtos tóxicos que danificam os neurónios.5
- Macrófagos infiltrados são difíceis de distinguir da microglia residente, mas as funções são, possivelmente, sobreponíveis.3
Astrócitos
- Presentes nas margens ativas das lesões desmielinizantes e na substância branca de aparência normal, o que pode sugerir que contribuam para o desenvolvimento das lesões iniciais.8
- Formam a cicatriz glial no centro das lesões na substância branca.8
- Libertam quimiocinas, citocinas inflamatórias e óxido nítrico sintase.8
- Promovem a sobrevivência das células B.8
Sistema Imunitário Adquirido
Periferia
Células T CD4+
- Ativadas pelas células apresentadoras de antigénios, diferenciando-se nos subtipos inflamatórios Th1 e Th17.9-13
- Libertam citocinas inflamatórias que têm demonstrado atrair e ativar outras células inflamatórias, exacerbando a manifestação da EM.9,13-15
- O seu mecanismo de regulação é deficiente, na EM.16
Células T CD8+
- Libertam citocinas inflamatórias que têm demonstrado atrair e ativar outras células inflamatórias, exacerbando a manifestação da EM9,13-15
- O seu mecanismo de regulação é deficiente, na EM.16
Células B
- Células apresentadoras de antigénios para ativar as células T.12
- Produzem anticorpos autorreativos que podem ser patogénicos.12
- O seu mecanismo de regulação é deficiente, em doentes com EMSR.10,17
Sistema Nervoso Central
Células T CD4+
- Presentes nas lesões ativas, sendo, contudo, uma minoria das células T encontradas nas lesões.7
- A sua presença no SNC diminui com a progressão da doença e da idade.7
- Libertam citocinas e quimiocinas que ativam as células residentes do SNC.7
Células T CD8+
- Presentes em todas as lesões ativas, representam a maioria das células T presentes nas lesões.7
- Ativadas nas lesões do SNC e têm um fenótipo que sugere sobrevivência e persistência dentro do SNC.7
- Reconhecem diretamente os antigénios do SNC e causam dano em oligodendrócitos e neurónios.7,12,18
- Libertam citocinas e quimiocinas que ativam a microglia.7
- A sua presença no SNC diminui com a progressão da doença e da idade.7
Células B
- Número variável em lesões, sendo a maior frequência observada em doentes com doença muito ativa e maior carga de lesões.7
- Em fases mais avançadas da doença, predominam os plasmócitos.7
- Podem ser encontradas no espaço perivascular de uma ou várias veias no centro das lesões e em estruturas linfoides terciárias.7
- Libertam citocinas, quimiocinas e anticorpos que ativam a microglia e recrutam células NK e sistema complemento.7
Lesões Agudas

- Contêm macrófagos/microglia, células B e células T.13,19
- Estado primordial das lesões.13,19
- Inflamação robusta que resulta em neurodegeneração.13,19
- Margens mal definidas.13,19
- Deposição de sistema complemento e imunoglobulinas.13,19
- Lesões da substância branca.13,19
Lesões crónicas ativas/Smoldering/ Lesões de expansão lenta

- Microglia/macrófagos apenas são encontrados nas margens das lesões crónicas ativas.13,19
- A inflamação e a degeneração da mielina podem persistir.13,19
- Lesões com anel paramagnético (paramagnetic rim lesions) são um tipo de lesões crónicas ativas caracterizadas pela presença de um anel de microglia com presença de ferro, que podem ser visualizadas com RM 7T ou 3T.20,21
- Existe inflamação ativa e destruição nas margens onde as células imunitárias e os astrócitos reativos são encontrados.13,19
- Anticorpos e sistema complemento são mais ativos em lesões crónicas ativas.13,19
- Pode ocorrer remielinização nas margens ou em toda a extensão da lesão.13,19
Lesões crónicas silenciosas

- Sem limite inflamatório ativo e com poucas células imunitárias ou inflamatórias.13,19
- Perda de oligodendrócitos e redução variável da densidade axonal.13,19
- Remielinização e células precursoras de oligodendrócitos são incomuns.13,19
Lesões Corticais Subpiais
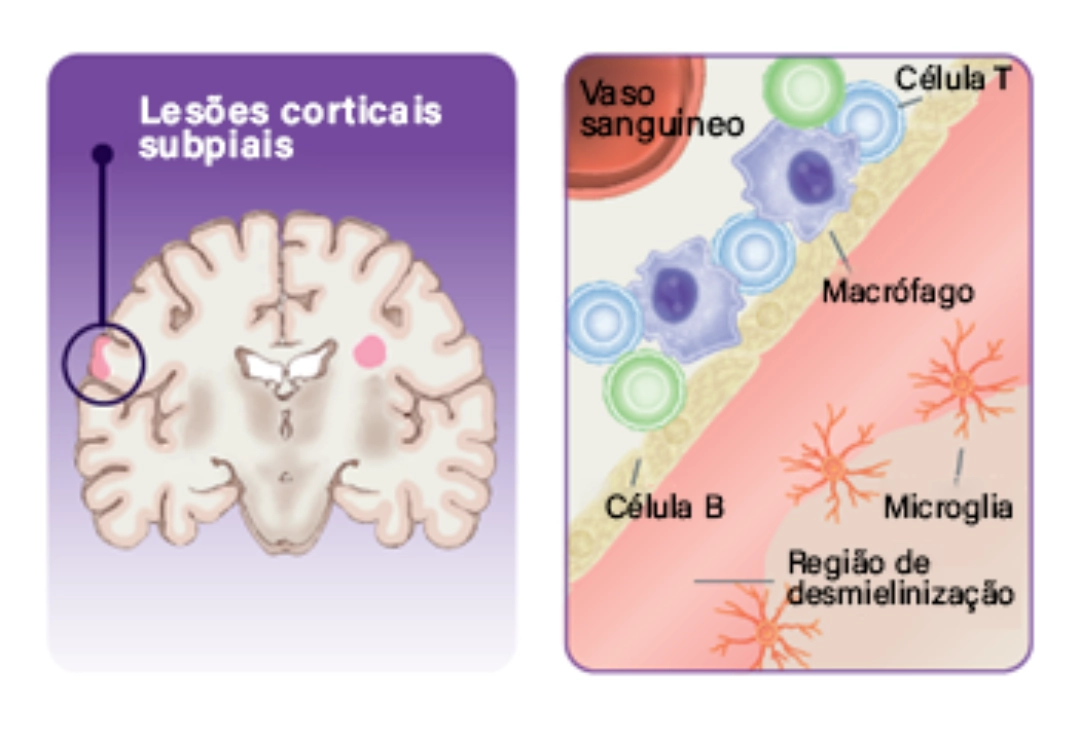
- Infiltrados meníngeos, que incluem macrófagos, células T e células B, podem induzir dano neuronal, axonal e em oligodendrócitos, direta ou indiretamente.22
- O dano direto pode ser causado pela produção de mediadores inflamatórios.22
- A ativação da microglia ocorre em lesões na substância cinzenta.22
- Perda ou disfunção dos astrócitos.22
- Disfunção mitocondrial.22
Perda de volume cerebral
- A perda de volume cerebral progride com o curso da doença.23
- A perda axonal irreversível e os processos neurodegenerativos podem resultar em perda de volume cerebral independente de surtos.24-26
- A perda de volume cerebral pode ocorrer como resultado da carga lesional total em conjunto com o dano difuso no SNC promovido pela microglia ativada.26
Referências
- Lassmann H. Pathogenic Mechanisms Associated With Different Clinical Courses of Multiple Sclerosis. Front Immunol. 2019 Jan 10;9:3116.
- Morgan BP, Gommerman JL, Ramaglia V. An "Outside-In" and "Inside-Out" Consideration of Complement in the Multiple Sclerosis Brain: Lessons From Development and Neurodegenerative Diseases. Front Cell Neurosci. 2021 Jan 7;14:600656.
- Zrzavy T, Hametner S, Wimmer I, et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 2017 Jul 1;140(7):1900-1913.
- Park E, Gallezot JD, Delgadillo A, et al. (11)C-PBR28 imaging in multiple sclerosis patients and healthy controls: test-retest reproducibility and focal visualization of active white matter areas. Eur J Nucl Med Mol Imaging. 2015 Jun;42(7):1081-92.
- Mishra MK, Yong VW. Myeloid cells - targets of medication in multiple sclerosis. Nat Rev Neurol. 2016 Sep;12(9):539-51.
- Gandhi R, Laroni A, Weiner HL. Role of the innate immune system in the pathogenesis of multiple sclerosis. J Neuroimmunol. 2010 Apr 15;221(1-2):7-14.
- Machado-Santos J, Saji E, Tröscher AR, et al. The compartmentalized inflammatory response in the multiple sclerosis brain is composed of tissue-resident CD8+ T lymphocytes and B cells. Brain. 2018 Jul 1;141(7):2066-2082.
- Ponath G, Park C, Pitt D. The Role of Astrocytes in Multiple Sclerosis. Front Immunol. 2018 Feb 19;9:217.
- Dittel BN. CD4 T cells: Balancing the coming and going of autoimmune-mediated inflammation in the CNS. Brain Behav Immun. 2008 May;22(4):421-30.
- Ireland S, Monson N. Potential impact of B cells on T cell function in multiple sclerosis. Mult Scler Int. 2011;2011:423971.
- Arnold CE, Gordon P, Barker RN, et al. The activation status of human macrophages presenting antigen determines the efficiency of Th17 responses. Immunobiology. 2015 Jan;220(1):10-9.
- Sospedra M, Martin R. Immunology of multiple sclerosis. Annu Rev Immunol. 2005;23:683-747.
- Wu GF, Alvarez E. The immunopathophysiology of multiple sclerosis. Neurol Clin. 2011 May;29(2):257-78.
- Goverman J. Autoimmune T cell responses in the central nervous system. Nat Rev Immunol. 2009 Jun;9(6):393-407.
- Raphael I, Nalawade S, Eagar TN, Forsthuber TG. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases. Cytokine. 2015 Jul;74(1):5-17.
- Cvetanovich GL, Hafler DA. Human regulatory T cells in autoimmune diseases. Curr Opin Immunol. 2010 Dec;22(6):753-60.
- von Büdingen HC, Bar-Or A, Zamvil SS. B cells in multiple sclerosis: connecting the dots. Curr Opin Immunol. 2011 Dec;23(6):713-20.
- Meuth SG, Herrmann AM, Simon OJ, et al. Cytotoxic CD8+ T cell-neuron interactions: perforin-dependent electrical silencing precedes but is not causally linked to neuronal cell death. J Neurosci. 2009 Dec 9;29(49):15397-409.
- Kuhlmann T, Ludwin S, Prat A, et al. An updated histological classification system for multiple sclerosis lesions. Acta Neuropathol. 2017 Jan;133(1):13-24.
- Dal-Bianco A, Grabner G, Kronnerwetter C, et al. Slow expansion of multiple sclerosis iron rim lesions: pathology and 7 T magnetic resonance imaging. Acta Neuropathol. 2017 Jan;133(1):25-42.
- Absinta M, Sati P, Fechner A, et al. Identification of Chronic Active Multiple Sclerosis Lesions on 3T MRI. AJNR Am J Neuroradiol. 2018 Jul;39(7):1233-1238.
- Calabrese M, Magliozzi R, Ciccarelli O, et al. Exploring the origins of grey matter damage in multiple sclerosis. Nat Rev Neurosci. 2015 Mar;16(3):147-58.
- Rudick RA, Fisher E, Lee JC, et al. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing-remitting MS. Multiple Sclerosis Collaborative Research Group. Neurology. 1999 Nov 10;53(8):1698-704.
- Trapp BD, Peterson J, Ransohoff RM, et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 1998 Jan 29;338(5):278-85.
- Dutta R, Trapp BD. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Prog Neurobiol. 2011 Jan;93(1):1-12.
- University of California, San Francisco MS-EPIC Team; Cree BAC, Hollenbach JA, Bove R, et al. Silent progression in disease activity-free relapsing multiple sclerosis. Ann Neurol. 2019 May;85(5):653-666.
MAT-PT-2300883 |V1.0 | Setembro de 2023










