Dupixent® fue estudiado en el programa de ensayos clínicos más grande de RSCcPN15
Dos ensayos fase 3, multicéntricos, multinacionales (SINUS-24; 12 países y SINUS-52: 14 países) , aleatorizados, doble ciegos y controlados con placebo con un total de 724 pacientes con RSCcPN grave.a,15
Objetivos primarios
Cambio desde el inicio a la semana 24 (ambos ensayos)
- Obstrucción/Congestión nasal medido por la puntuación CN (promediado durante 28 días)
- Tamaño del Pólipo Nasal medido por NPS endoscópico
a.Todos los pacientes en los brazos de placebo y DUPINEX® estaban en una terapia base de CIN, spray nasal de furoato de mometasona.
b.En SINUS-52, los datos desde el inicio hasta la semana 24 se combinan en los grupos de tratamiento DUPIXENT® Q2W (n=295).
c. La dósis recomendada de DUPIXENT® para pacientes adultos con RSCcPN es de 300 mg administrados por vía subcutánea en semanas alternas.
RSCcPN (Rinosinusitis Crónica con Poliposis Nasal); CIN ( Corticosteroides intranasales); Q2W ( una vez cada dos semanas); Q4W (una vez cada cuatro semanas); CN (onstrucción/congestión nasal); NPS (Puntaje de pólipo nasal).
Adultos ( >18 años) con rinosinusitis crónica grave con pólipos nasales bilaterales (n=724)
- Sin control a pesar del uso previo de CSS (o contraindicación médica o intolerancia) en los últimos 2 años, cirugía de PN previa o ambos.
- NPS endoscópico bilateral mínimo de 2 por cada fosa nasal y >2 de los siguientes síntomas durante >8 semanas: congestión u obstrucción nasal con síntomas de severidad moderada o grave y pérdida del olfato o rinorrea anterior o posterior.
- En terapia de base con Corticoesteroides intranasales.*
No se requirieron criterios de biomarcadores asociados con RSCcPN o inflamación Tipo 2 al inicio del estudio para inscribirse en los ensayos'*
- Se permitió el rescate con esteroides sistémicos o cirugía a discreción de los investigadores.
- No se incluyeron los pacientes con RSC sin poliposis nasal.
*En ambos ensayos, los pacientes recibieron un spray nasal de 100 mg de furoato de mometasona durante un período previo de 4 semanas y durante todo el ensayo.*
CSS (Corticosteroides Sistémicos); PN(Pólipos Nasales), NPS (Puntaje de Pólipo Nasal), CIN (Corticosteroides Intranasales), RSCcPN (Rinosinusitis Crónica con Poliposis Nasal) , RSC (Rinosinusitis Crónica).
| Características | Media (DE) o n (%) |
| Edad | 52 (42-61) años |
| Duración del pólipo nasal | 11,01 (9,45) años |
Cirugía previa de pólipos nasales:
|
52 (42-61) años |
| Puntaje de pólipo nasal bilateral endoscópico | 5,97 (1,25) |
| Puntaje de congestión nasal | 2,40 (0,58) |
| Puntaje de TC Lund-Mackay | 18,37 (4,06) |
| Puntaje SNOT-22 | 50,94 (20,66) |
| Puntaje UPSIT | 13,98 (8,21) |
| Asma | n=428 (59%) |
| Erea | n=204 28%) |
- EL 74% de los pacientes reportaron uso previo de corticoesteroides sistemáticos en los últimos 2 años.
- -80% de los pacientes incluidos tenían antecedentes de enfermedades inflamatorias Tipo 215.
RSCCPN (Rinosinusitis Crónica con Poliposis Nasal), TC (Tomograña Computarizada); SNOT-22 (Prueba de resultado sino-nasal de 22 items): EREA (Enfermedad Respiratoria Exacerbada por la Aspirina) ; UPSIT (Prueba de identificación del olfato de la Universidad de Pennsylwania).
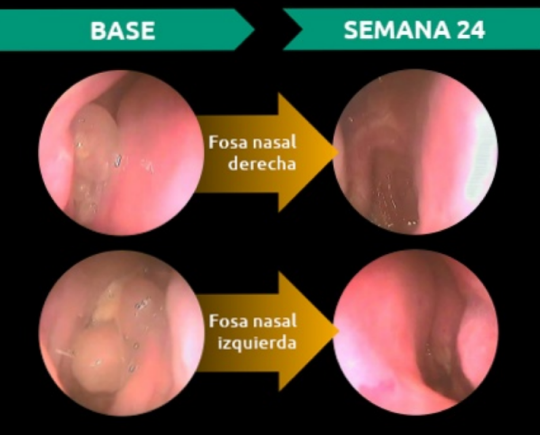
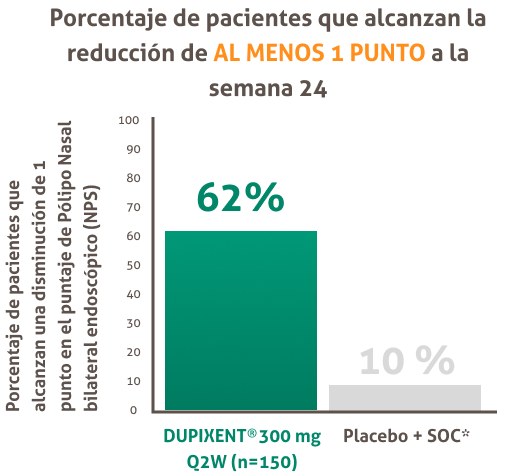
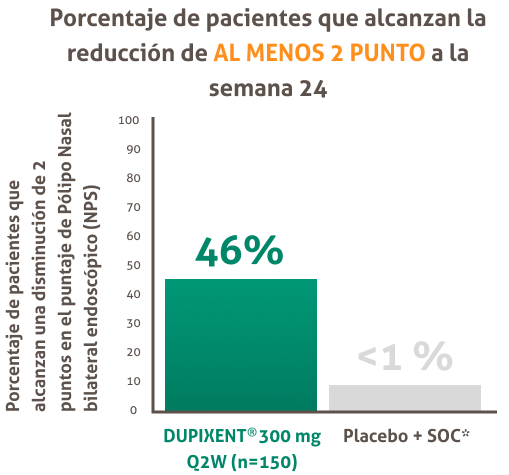
DUPIXENT® redujo significativamente el tamaño de los pólipos nasales vs. placebo + CIN según el NPS con reducción significativa y sostenida desde la semana 8 hasta la semana 52:'
*100 mg de MFNS en cada fosa nasal dos veces al día. Se permitió el lavado nasal con solución salina, antibióticos sistemáticos, COS de ciclo corto o cirugía nasosinusal según fuera necesario durante el tratamiento y los períodos de seguimiento.
SOC ( Estándar de Cuidado) , Q2W ( una vez cada dos semanas) , NPS ( Puntaje de Pólipo Nasal).
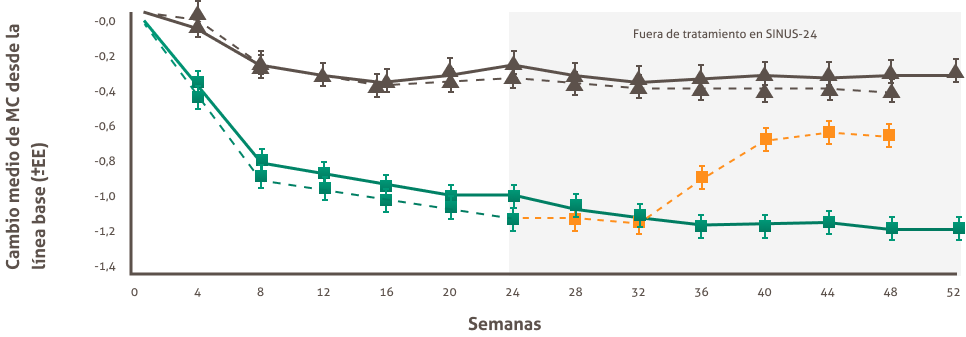
DUPIXENT® reduce significativamente la puntuación de Congestión Nasal Frente a placebo + CIN desde la semana 4, en la semana 24 y se mantuvo hasta la semana 52.1,15
Cambio en la puntuación de congestion nasal en SINUS-52, hasta la semana 52 (objetivo secundario) 15
Los pacientes calificaron diariamente la puntuación de congestión/obstrucción nasal (CN) en una escala de gravedad categórica de O a 3 (0 = no sintomas; 1 = síntomas leves; 2 = sintomas moderados; 3 = síntomas graves): la puntuación reducida indica mejoria.
a. (Objetivo primario) con DUPIXENT? QW2 + CIN (n=295 grupos de DUPIXENT* combinados)(-1,25 desde una puntuación inicial de 2,46)
frente a una mejora del 16 % con placebo + CIN (n=153) (-0,38 dede una pun tuación inicial de 2,38) (diferencia en LSM: 0,87 [IC del 95 %: -1,03, -0,71]).
b. Con DUPIXENT? (en comparación con una puntuación inicial de 2,48) vs. 16 % de mejora con placebo (en comparación con una puntuación inicial de 2,38) . (Diferencia LSM- -0,98 [IC del 95 %: -1, 17, -079]).
CN (Congestión/obstrucción nasal); LSM (Media de minimos cuadrados); CIN (corticosteroides intranasales);: Q2W (una vez cada dos semanas).
Disminución significativa de la congestión/obstrucción nasal15
*100 mg de MFNS en cada fosa nasal dos veces al día.! 'Se permitió el lavado nasal con solución salina, antibióticos sistémicos, COS de cido corto o cirugía nasosinusal según fuera necesario durante el tratamiento y los periodos de seguimiento.
MC (Minimos Cuadrados); MFNS (Furato de Mometasona Spray Nasal); CN (Congestión Nasal); Q2W (una vez cada dos semanas); COS (Corticosteroides sistémicos); EE (Error Estándar); SOC (Estándar de Cuidado) .
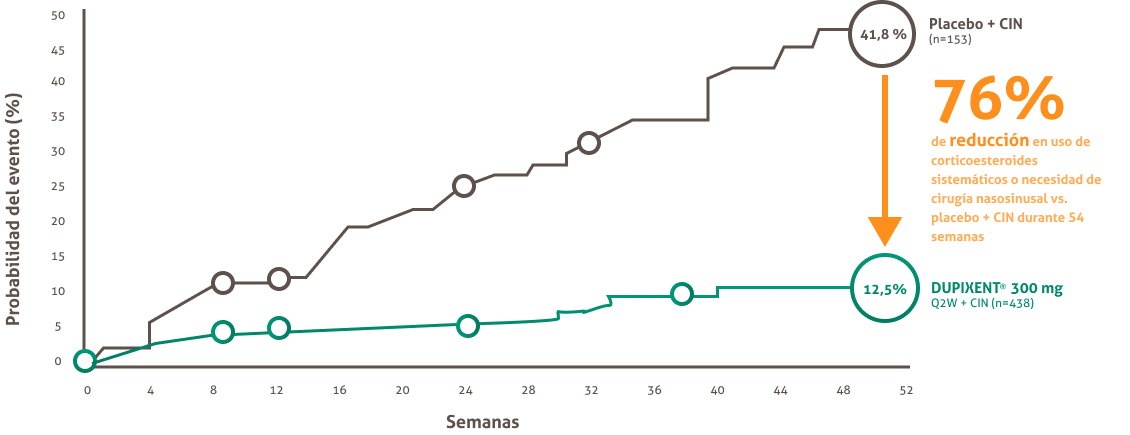
Tiempo hasta el primer uso de esteroides sistémicos y/o cirugía nasosinusal durante el período del tratamiento (análisis combinado)
- Hasta 74% menor requerimiento de coritcoesteroides sistémicos a la semana 52.
-
Hasta 83% Menor requerimiento de cirgugía nasosinusal de revisión a la semana 52.15
3. Con DUPIXENT? 300 mg Q2W + CIN (Día 0: n=435; Semana 24: n=376; Semana 52: n=100) vs. placebo (Día 0: n=286; Semana 24: n=187; Semana 52 , n=61) en 52 semanas en un análisis combinado de las puertas 1 y 2. ( HRc 0,24 [IC del 95 %: 0, 17, 0,35]).
CIN ( corticosteroides intranasales) , Q2W ( una vez cada dos semanas) , HR ( conciente de riesgo).
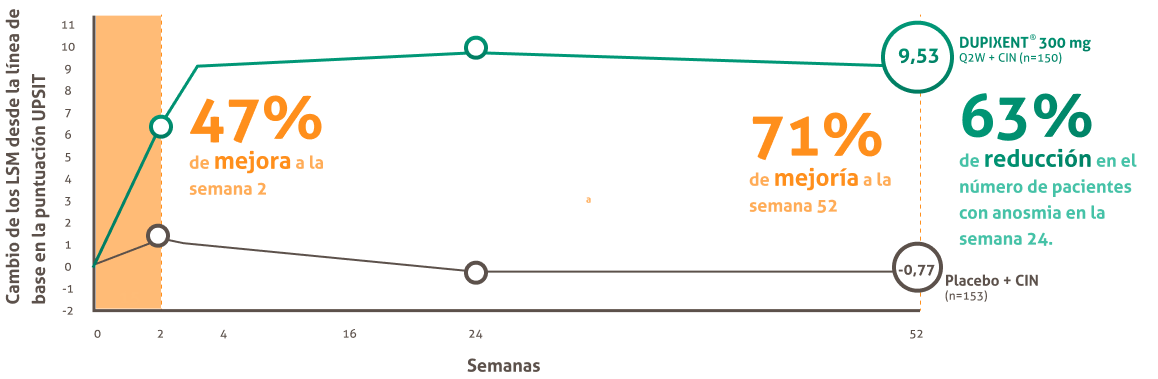
La prueba de identificación del olfato de la Universidad de Pensilvania (UPSIT) evalúa la Función olfativa con una prueba de 40 olores. La puntuación varía de O a 40 (35-40 = apreciación del olor normal; 31-34 = microsmia leve; 26-30 = microsmia moderada; 19-25 = microsmia grave; <18 = anosmia) una puntuación más alta indica mejoría.
a. con DUPIXENT? (6,34 comparado con una puntuación inicial de13,46) vs 7% de mejora con placebo (0,98 comparado con una puntuación inicial de 13,78) (diferencia del LSM: 5,36 [1C del 95%: 3,62, 7,10])15 b. De 228 pacientes con anosmia al inicio del estudio se redujo a 84 pacientes según la puntuación UPSIT ala semana 24. b. Con DUPIXENT? (en comparación con una puntuación inicial de 13,46) vs. 6 % de empeoramiento con placebo (en comparación con una puntuación inicial de 13,78) (diferencia del LSM: 10,30 [IC del 95%: 8,50 ,12,10)). c. De 228 pacientes con anosmia al inicio del estudio se redujo a 84 pacientes según la puntuación UPSIT a la semana 24.
UPSIT (Prueba de identificación del Olfato de la Universidad de Pensilvania), LSM (Media de Mínimos cuadrados), Q2W ( una vez cada dos semanas), CIN ( corticosteroides intranasales).
DUPIXENT® mejoró significativamente el puntaje de Lund Mackay vs. placebo + CIN a la semana 24, y aún más en la semana 52.
El puntaje de tomografía computarizada Lund-Mackay (LMK-CT) evalúa la opacificación de cada seno usando una escala
de 0 a 2 (0=normal; 1=opacificación parcial; 2=0pacificación total) obteniendo una puntuación máxima de 12 por lado y un máximo total de 24. Puntuaciones más altas indican más opacificación < puntuaciones reducidas indican mejoría.
- 28% de mejoría a la semana 24. (n=295) (-5,21 Puntos - Puntaje inicial de18,12) vs. 0,5 % de mejora con placebo + CIN (n=153) (-0,09 Puntos - Puntaje inicial de 17,65)
- 37% de mejoría a la semana 52. (n=150) (-6,83 Puntos - Puntaje inicial de 18,42) vs. 0,6 % de empeoramiento con placebo + CIN (n=153) (+0,11 Puntos - Puntaje inicial de 17,65)
Objetivo secundario con DUPIXENT® 300 mg Q2W + CIN.
CIN (Corticosteroides Intranasales); Q2W (una vez cada dos semanas).
Imágenes ilustrativas.
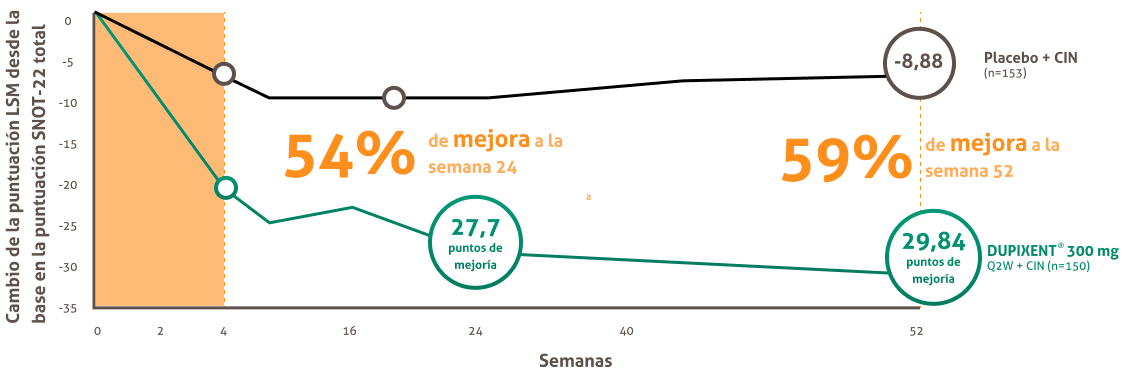
DUPIXENT® disminuyó significativamente la puntuación SNOT-22 vs. placebo + CIN ya a la semana 4, manteniendose hasta las semanas 24 y 52.1,15
Cambio en la puntuación snot-22 hasta la semana 52 en sinus-52
El cuestionario SNOT-22 aborda 22 sintomas relacionados con las funciones sino-nasales y auriculares, la calidad del sueño,
el impacto psicológico y la productividad. En una escala total de 110 puntos, la diferencia clinicamente significativa es 8,9.
«Mejoría en calidad de vida relacionada con la salud.
a. (Comparado a una puntuación inicial de S0,16) vs. mejoria del 17 % con placebo (comparado a una puntuación inicial de 53,48)
La prueba de resultado sino-nasal de 22 items (SNOT-22) indluye 22 elementos que evalúan los sintomas y sus impactos asociados con RSCCPN La puntuación va desde 0 Csin problema”) a S (problema tan mal como puede ser”).
RSCcPN (Rinosinusitis Crónica con poliposis Nasal), CIN (Corticosteroides Intranasales), Q2W (una vez cada dos semanas), LSM (Media de Mínimos Cuadrados).
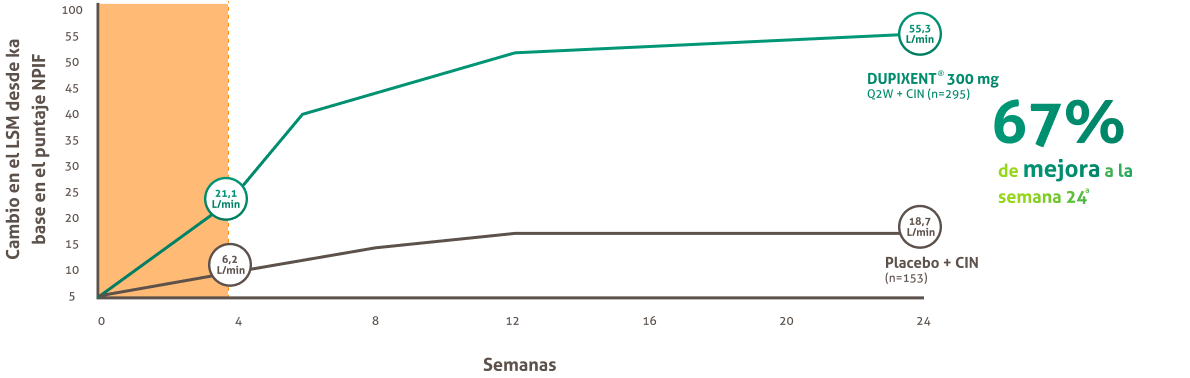
DUPIXENT® mejoró significativamente el Flujo Nasal Inspiratorio Pico (PNIF) vs. placebo + CIN a la semana 4, con mejora continua hasta la semana 24. 1,16
Cambio en el pnif hasta la semana 24 en sinus-52
El Flujo Nasal Inspiratorio Pico (PNIF) mide el Flujo del aire a través de ambas cavidades nasales durante la inspiración
forzada expresada en litros por minuto: (L/min) números más altos indican mejoria.
-2,5X Menor Rinorrea DUPIXENT® mejoró significativamente el puntaje de los síntomas diarios de rinorrea a la semana 24 en SINUS-52. 15
El puntaje de síntomas diarios de rinorrea se evalúa por pacientes en una escala de O a 3, puntajes bajos indican mejoria.
a. Con DUPIXENT? Q2W+ CIN (puntaje base de 83,0) vs. 21 % de mejora con placebo (puntaje base 87,5). b. Con DUPIXENT? 300 mg Q2W + CIN (n=295, y grupos combinados de DUPIXENT?) (-0,99 de Dase) vs. placebo + CIN (n=153) (-0,44 de la base).
PNIF (Peak Nasal Inspiratory Flow o Flujo Nasal Inspiratorio Pico); CIN (Corticosteroides Intranasales); Q2W (una vez cada dos semanas); LSM (Media de Minimos Cuadrados).
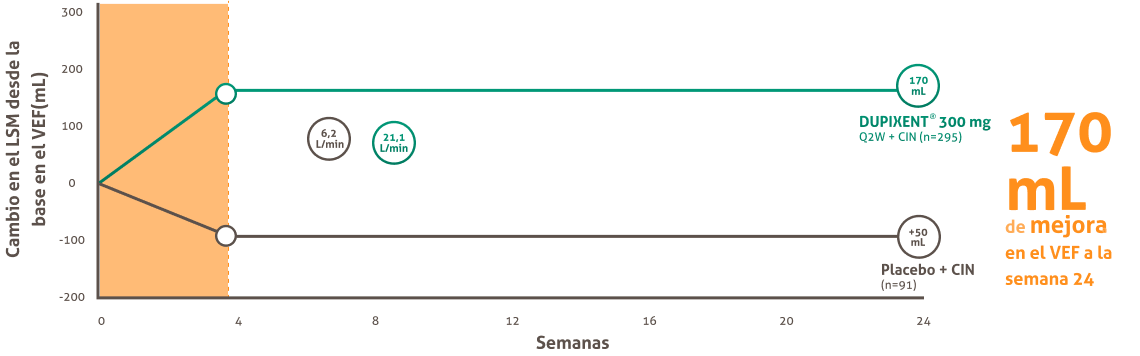
DUPIXENT® mejoró significativamente la Función pulmonar vs. placebo + CIN a la semana 4, con mejora continua hasta la semana 24.15,16
Cambio en la función pulmonar hasta la semana 24 en sinus-52*
|
Función Pulmonar (VEF) |
Normal (adultos) |
>750-800 mL | Cambio clinicamente significativos en el VEF : 100-200 mL |
| Asma (adultos) |
+ 12% y + 200 desde la línea base representan la variabilidad en el flujo de aire espiratorio observado en el asma. |
Dupixent® mejoró la Función pulmonar (VEF ) independientemente del nivel de eosinófilos basal.
a. (Diferencia de LSM vs placebo: 210 mL [IC del 95%: 110, 320 mL] .
VEF, (Volumen Respiratorio Forzado em el 1er segundo); RSCCPN (Ri nosinusitis Crónica con Poliposis Nasal); CIN (Corticosteroides intranasales); Q2W ( una vez cada dos semanas) , LSM (Media de Mínimos Cuadros).
1. Dupixent? último prospecto aprobado, 2021.
15. Bachert C, Han JK, Desrosiers M, et al. Eficacia y seguridad de dupilumab en pacientes con rinosinusitis crónica grave con pólipo nasal (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): resultados de dos ensayos de fase 3 multicéntricos, aleatorizados, doble ciego, controlados con placebo y de grupos paralelos Lancet. 2019;394 (10209):1638-1650.



.png)


.png/jcr:content/nefrologia%20(1).png)
.png/jcr:content/cardiologia%20(1).png)
.png/jcr:content/opciones%20(1).png)
.png/jcr:content/controversias%20(1).png)
.png/jcr:content/tratamiento%20(1).png)
.png/jcr:content/psicologia%20(1).png)
.png/jcr:content/lo-nuevo%20(1).png)
.png/jcr:content/pediatria%20(3).png)
.png/jcr:content/HVI%20(1).png)
.png/jcr:content/variantes%20(1).png)
.png/jcr:content/hipoacusia%20(1).png)
.png/jcr:content/afectacion%20(1).png)
.png/jcr:content/generalidades%20(1).png)
.png0/jcr:content/mecanismos%20(1).png)
.png/jcr:content/neurologia%20(1).png)
.png/jcr:content/terapias%20(1).png)
.png/jcr:content/diagnostico%20(2).png)
.png/jcr:content/CS%20webinarThumbnail%20(1).png)
























