
Liberty Ad Peds
Ensayo que evaluó dupilumab y corticoesteroides tópicos (CET) en niños entre 6-11 años con dermatitis atópica severa con control inadecuado con tratamiento tópico. Estudio de fase 3, aleatorizado, doble ciego, comparado con placebo en tres grupos paralelos.
- A. S. Paller, E. C. Siegfried, D. Thaçi, A. Wollenberg, M. J. Cork, P. D. Arkwright, M. Gooderham, L. A. Beck, M. Boguniewicz, L. Sher, J. Weisman, J. T. O’malley, N. Patel, M. Hardin, N. M. H. Graham, M. Ruddy, X. Sun, J. D. Davis, M. A. Kamal, F. A. Khokhar, D. M. Weinreich, G. D. Yancopoulos, B. Beazley, A. Bansal, Y B. Shumel.
Evaluar la eficacia y seguridad de DUPIXENT + CET en niños entre 6-11 años con dermatitis atópica severa con control inadecuado con tratamiento tópico.
Diseño del estudio
Estudio multicéntrico, aleatorizado, doble ciego, comparado con placebo, en grupos paralelos, de fase 3.
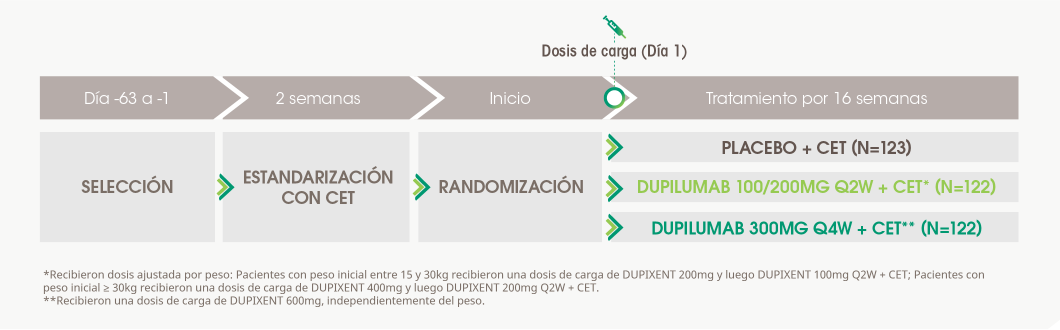
Luego se realizó seguimiento por hasta 12 semanas únicamente para aquellos pacientes que rechazaron o no eran elegibles para participar en la extensión abierta del ensayo.
Se permitió tratamiento de rescate con CET de alta potencia o terapia sistémica en aquellos pacientes con un puntaje IGA de 4 o síntomas intolerables durante el período de tratamiento. Los CET de muy alta potencia estaban prohibidos, incluso en forma de rescate.
Criterios de selección específicos
- Niños de ≥ 6 y ≤ 11 años con DA
- ≥1 año de DA
- Puntaje IGA de 4
- Puntaje EASI ≥21
- Superficie corporal afectada ≥15%
- Peor puntaje de prurito inicial promediado semanalmente (Escala de calificación numérica [NRS] del prurito máximo) ≥4
- Peso ≥15 kg
- Historial documentado de respuesta inadecuada a medicación tópica para DA dentro de los 6 meses del inicio del estudio.
Criterios de valoración primarios
- % de pacientes que alcanzaron IGA 0 o 1 (piel sin lesiones o casi sin lesiones) a la semana 16.
Criterios de valoración secundarios
- Incidencia y tasa de SAEs surgidos por el tratamiento y TEAEs de especial interés.
Criterios de valoración co-primarios
- % de pacientes que alcanzaron un EASI-75 (≥75% de mejora desde el inicio) a la semana 16.
Criterios de valoración secundarios específicos
- % de cambio en EASI
- Cambios semanales promedio desde el inicio hasta las 16 semanas en:
- Puntaje máximo de prurito en NRS (%; semanal)
DA, dermatitis atópica; CET, corticoesteroides tópicos; EASI, Índice de gravedad y área del eczema; IGA, Evaluación Global del Investigador; NRS, Escala de puntaje numérica; Q2W, una vez cada 2 semanas; Q4W, una vez cada 4 semanas; POEM, Medición del Eczema Orientado al Paciente; CDLQI, Índice de Calidad de Vida Dermatológico en niños; DFI, impacto familiar de la dermatitis; PROMIS, sistemas de información de mediciones de resultados informados por el paciente.
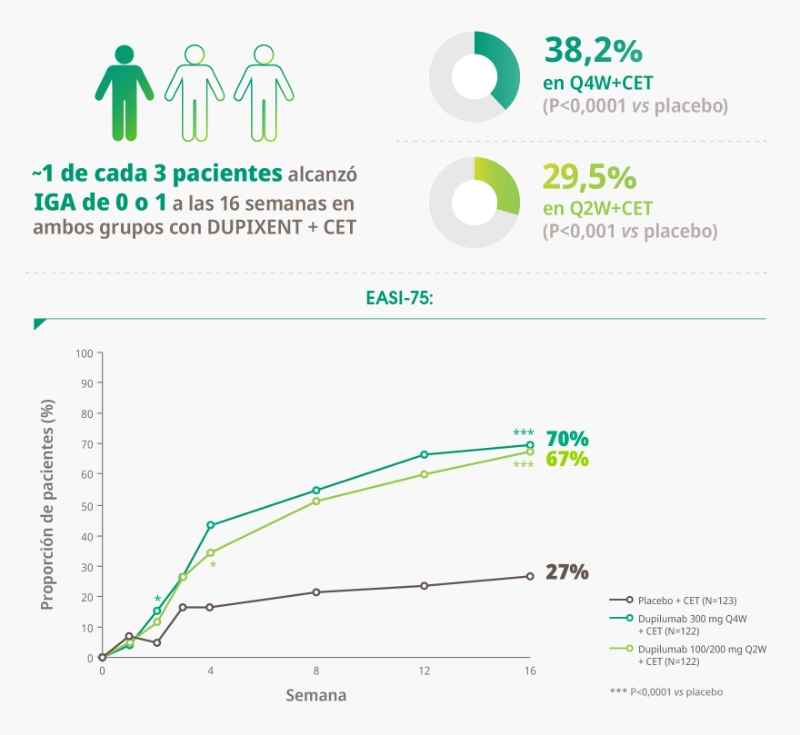
- Aproximadamente un 60% y 68% de los pacientes que recibieron DUPIXENT + CET (grupos Q4W+CET y Q2W+CET, respectivamente) alcanzaron una mejoría significativa del prurito vs 21% de los pacientes que recibió placebo (P < 0.0001).
- Se observó una mejoría significativa en la calidad de vida relacionada con la salud de los pacientes que recibieron DUPIXENT + CET, según lo evaluado por el cambio medio desde el inicio en la POEM, CDLQI, DFI y las puntuaciones de ansiedad y depresión de PROMIS.
- Una mayor proporción (19,2%) de pacientes que recibieron placebo + CET requirieron medicación de rescate en comparación con ambos grupos de DUPIXENT + CET (2,5% y 4,9%; grupos Q4W+CET y Q2W+CET, respectivamente)
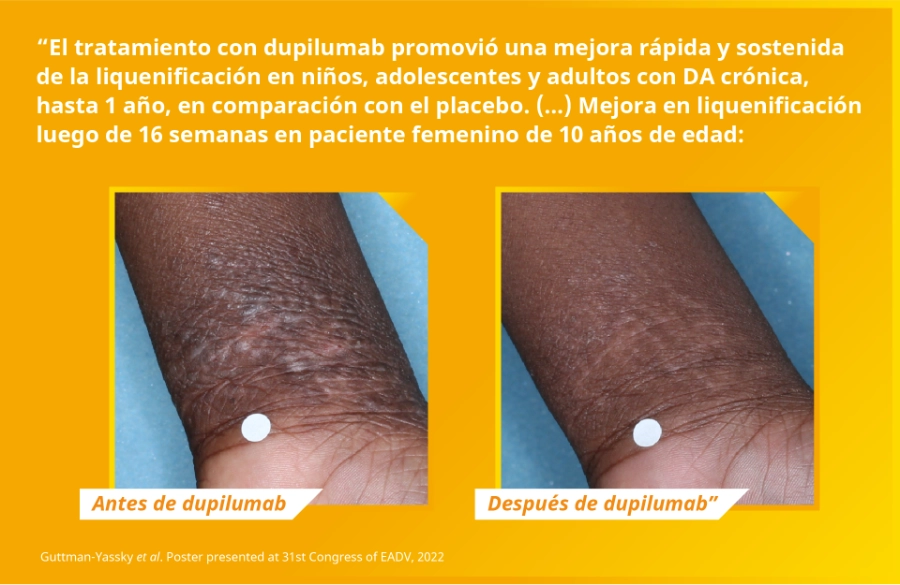
En niños entre 6 y 11 años con dermatitis atópica severa, DUPIXENT + CET proporcionó una mejora significativa en:
- La extensión y severidad de las lesiones de la piel
- Intensidad del prurito
- Medidas de la calidad de vida y sueño
Seguridad y tolerabilidad:
- La incidencia general de eventos adversos emergentes del tratamiento (TEAEs) fue menor en los grupos de DUPIXENT + CET.
- La suspensión de la medicación debido a efectos adversos fue poco común (n=2 en el grupo placebo + CET; n=2 en DUPIXENT Q2W + CET).
- No se observaron muertes ni hipersensibilidad o eventos de anafilaxia relacionados con el tratamiento a lo largo del estudio.
- Se observó tendencia hacia una menor incidencia de efectos adversos relacionados con exacerbación de DA en el grupo DUPIXENT Q4W+CET comparado con el grupo DUPIXENT Q2W+CET.
- Los efectos adversos más comunes reportados fueron:
- Infección de tracto respiratorio superior
- Vómitos
- Cefalea
- Reacciones en el sitio de aplicación
- Conjuntivitis
- Paller, Amy S et al. “Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial.” Journal of the American Academy of Dermatology vol. 83,5 (2020): 1282-1293. doi:10.1016/j.jaad.2020.06.054

.png/jcr:content/nefrologia%20(1).png)
.png/jcr:content/cardiologia%20(1).png)
.png/jcr:content/opciones%20(1).png)
.png/jcr:content/controversias%20(1).png)
.png/jcr:content/tratamiento%20(1).png)
.png/jcr:content/psicologia%20(1).png)
.png/jcr:content/lo-nuevo%20(1).png)
.png/jcr:content/pediatria%20(3).png)
.png/jcr:content/HVI%20(1).png)
.png/jcr:content/variantes%20(1).png)
.png/jcr:content/hipoacusia%20(1).png)
.png/jcr:content/afectacion%20(1).png)
.png/jcr:content/generalidades%20(1).png)
.png0/jcr:content/mecanismos%20(1).png)
.png/jcr:content/neurologia%20(1).png)
.png/jcr:content/terapias%20(1).png)
.png/jcr:content/diagnostico%20(2).png)
.png/jcr:content/CS%20webinarThumbnail%20(1).png)
























