
Liberty Ad Ped Ole
Resultados a largo plazo de seguridad, eficacia y perfil farmacocinético de Dupilumab en adolescentes con dermatitis atópica (DA) moderada a severa.
Resultados de la cohorte de pacientes ≥ 12 y < 18 años hasta la semana 52 de un estudio de extensión abierto (OLE), fase III, multicéntrico.
Diseño del estudio
Evaluar a largo plazo la seguridad, eficacia y perfil farmacocinético de DUPIXENT en adolescentes con DA moderada a severa.
Criterios de inclusión
- Adolescentes ≥ 12 y < 18 años con DA moderada a severa.
- Haber participado previamente en ensayos clínicos de Dupilumab para DA y haber completado todas las visitas/evaluaciones (para el estudio NCT02407756) o al menos 50% de las visitas y evaluaciones (para los estudios NCT03054428 y NCT03050151).1
Criterios de valoración primarios
- Incidencia y tasa de TEAEs.
Criterios de valoración secundarios
- Incidencia y tasa de SAEs surgidos por el tratamiento y TEAEs de especial interés.
Criterios de valoración adicionales
- % de pacientes con un puntaje IGA 0 o 1 en la semana 52.
- % de pacientes con EASI-75 en la semana 52.
- % de cambio desde el inicio del estudio de base en EASI y SCORAD hacia la semana 52.
- Cambio medio en EASI hacia la semana 52.
- Cambios desde el inicio del estudio de base en BSA afectada y EASI hacia la semana 52.
- Cambio desde el inicio del estudio de base en CDLQI en la semana 52.
- % de pacientes que lograron EASI 50/75/90 desde el inicio del estudio base hasta la semana 52.
- Evaluación de las concentraciones mínimas de DUPIXENT funcional en suero después del tratamiento.
Criterios de valoración Post hoc
- % de pacientes con IGA de 0 o 1 de forma sostenida durante 12 semanas, en la semana 52.
- Tiempo hasta el reinicio de la terapia con DUPIXENT después de la recaída luego de alcanzar por primera vez de forma sostenida IGA de 0 o 1.
- Número de pacientes que recuperaron IGA 0 o 1 después de reiniciar el tratamiento.
Q2W, cada 2 semanas; Q4W, cada 4 semanas; TEAE, Eventos Adversos Surgidos por el Tratamiento; AE, Evento Adverso; SAE, Evento Adverso Grave; IGA, Evaluación Global de los Investigadores; EASI, Índice de puntuación de Severidad y del Área con Eczema; EASI-50/75/90, Pacientes que Alcanzaron ≥50%/≥75%/≥90% de Reducción en EASI; BSA, Superficie corporal; CDLQI, Índice de Calidad de Vida Dermatológico en niños; SCORAD, Puntuación de la Dermatitis Atópica.

Un 73,8% de los pacientes reportó uno o más TEAEs, siendo la mayoría de intensidad leve a moderada, de duración transitoria y no llevaron a discontinuar el tratamiento.
De los 1131 TEAEs reportados, únicamente 120 se consideraron relacionados al tratamiento.

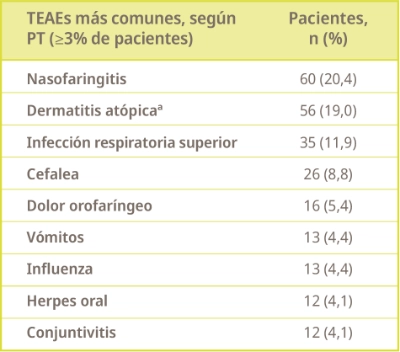
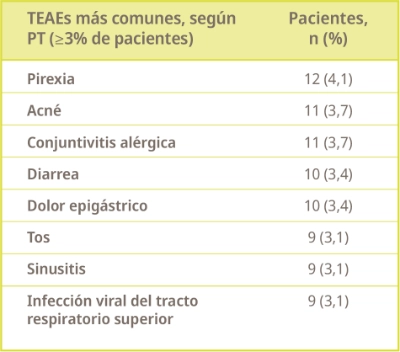
PT, término preferente. aEmpeoramiento de dermatitis atópica.
En el análisis de eficacia se incluyeron datos de 294 pacientes que recibieron tratamiento con DUPIXENT 300mg Q4W o régimen aumentado a DUPIXENT Q2W escalonado por peso en la extensión abierta del ensayo. Los signos clínicos mostraron una mejora sustancial sostenida en el tiempo. Además, se observó mejoría clínica independientemente del peso corporal.
Hacia la semana 52:
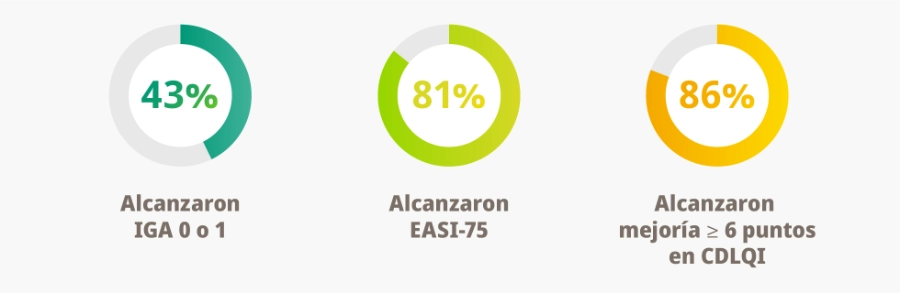
Además:
- 93,1% y 56,4% alcanzaron EASI-50 y EASI-90, respectivamente.
- 86,4% alcanzaron al menos un IGA ≤ 2 (afectación leve).
- % medio de cambio en EASI de -83,5% (±23,5) y en SCORAD de -65,0% (±23,5).
- Cambio medio desde el inicio del estudio de base:
- BSA afectada -42,7% (±26,2).
- EASI -28,5.
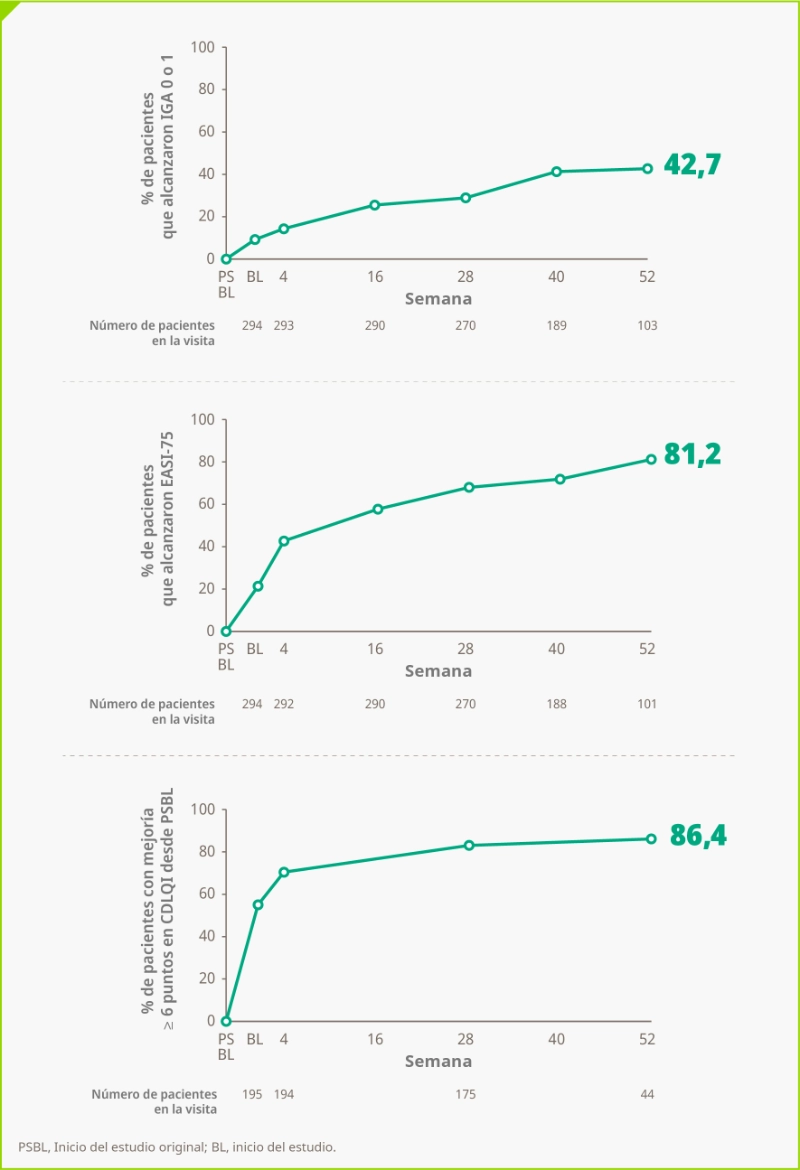
Las concentraciones mínimas medias de DUPIXENT funcional en el suero de los pacientes asignados a DUPIXENT 300mg Q4W al inicio, alcanzaron un estado de equilibrio estacionario de aproximadamente 20 mg/L hacia la semana 16, que se mantuvo hasta la semana 52 en pacientes que continuaron con este régimen.
- Blauvelt, Andrew et al. “Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open-Label Extension Trial (LIBERTY AD PED-OLE).” American journal of clinical dermatology vol. 23,3 (2022): 365-383. doi:10.1007/s40257-022-00683-2

.png/jcr:content/nefrologia%20(1).png)
.png/jcr:content/cardiologia%20(1).png)
.png/jcr:content/opciones%20(1).png)
.png/jcr:content/controversias%20(1).png)
.png/jcr:content/tratamiento%20(1).png)
.png/jcr:content/psicologia%20(1).png)
.png/jcr:content/lo-nuevo%20(1).png)
.png/jcr:content/pediatria%20(3).png)
.png/jcr:content/HVI%20(1).png)
.png/jcr:content/variantes%20(1).png)
.png/jcr:content/hipoacusia%20(1).png)
.png/jcr:content/afectacion%20(1).png)
.png/jcr:content/generalidades%20(1).png)
.png0/jcr:content/mecanismos%20(1).png)
.png/jcr:content/neurologia%20(1).png)
.png/jcr:content/terapias%20(1).png)
.png/jcr:content/diagnostico%20(2).png)
.png/jcr:content/CS%20webinarThumbnail%20(1).png)
























