
Quest: Asma, estudio clínico
Eficacia Y Seguridad De Dupilumab en Asma Moderada | A Severa No Controlada
Ensayo pivotal de fase 3 que evaluó la eficacia y la seguridad de Dupilumab durante 52 semanas
Autores: Castro M, Corren J, Pavord ID, et al. N Engl J Med. 2018;378(26):2486-2496.
En pacientes con asma severa evaluar la eficacia y la seguridad de Dupilumab en pacientes ≥12 años
Criterio de valoración primarios
- Cambio absoluto en el FEV pre broncodilatador desde el nivel basal hasta la Semana 12 en comparación con placebo + SOC
- Tasa anualizada de exacerbaciones severas hasta la Semana 52.
Diseño del estudio
Fase 3, randomizado, doble ciego, controlado con placebo, en grupos paralelos

Características basales seleccionadas
52%
de los pacientes utili zaban dosis altas de ICS
82%
reortaron antecedentes de condiciones atópicas
2,09
exacerbaciones en el último año
Los Pacientes Fueron Incluidos Independientemente Del Nivel Basal De Eosinófilos, Ige, O Feno
Criterios de inclusión
- Diagnóstico médico de asma de más de 12 meses
- Tratado con dosis media a alta de ICS 1 y hasta 2 medicacioes controladoras adicionales
- FEV1 pre broncodilatador ≤80% del predicho (≤90% del predicho para pacientes de 12 a 17 años de edad)
- FEV1 ≤80% del predicho para adultos y ≤90% del predicho para adolescentes
- Reversibilidad ≥12% y 200 ml del FEV1
- Puntuación ACQ-5 ≥1,5 al momento de screening y al inicio del estudio
- Empeoramiento del asma en el año previo al screening lue condujo a uno de los siguientes eventos
-
Hospitalización o consulta al departamento de emergencias
-
Tratamiento con corticoesteroides sistémicos durante 3 dhas o más
-
-
Los pacientes fueron incluidos sin reluisitos mhnimos de eosinófilos en sangre o esputo al inicio del estudio ni de cualluier otro biomarcador Tipo 2 como FeNO o IgE
ACQ-5, Cuestionario de control del asma, versión de 5 htems; FeNO, óxido nhtrico inhalado fraccional; FEV1, volumen espiratorio forzado en 1 segundo; ICS, corticosteroides inhalados; Q2W, una vez cada 2 semanas; SOC, tratamiento estándar.
Criterios de valoración
Fase 3, randomizado, doble ciego, controlado con placebo, en grupos paralelos
Mejoría en Función Pulmonar
El cambio absoluto en el FEV1 pre-bronco dilatadordes de el inicio fue significativamente mayor con Dupilumab a la Semana 12 en comparación con placebo SOC
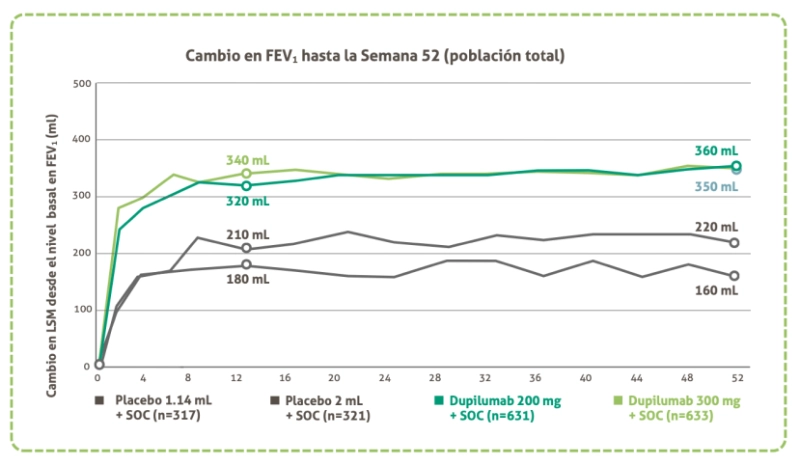
Mejoría en Función Pulmonar: Subgrupos
Criterio de valoración secundario
A la semana 12 con eosinófilos ≥300 células/μL
430 ML Mejoría Desde el nivel basal
En el FEV1 pre-broncodilatador con Dupilumab 200 mg SOC (n=264) frente a 210 ml con placebo SOC (n=148) (diferencia de LSM 210 ml [95% CI: 130, 290 ml]) LSM, media de mhnimos cuadrados.
A la semana 52 con FeNO ≥25ppb1
490 ML Mejoría Desde el nivel basal
En el FEV1 pre broncodilatador con Dupilumab 200 mg SOC (n=288) frente a 180 ml con placebo SOC (n=157) (diferencia de LSM 300 ml [95% CI: 220, 390 ml])30, 290 ml]) LSM, media de mhnimos cuadrados.
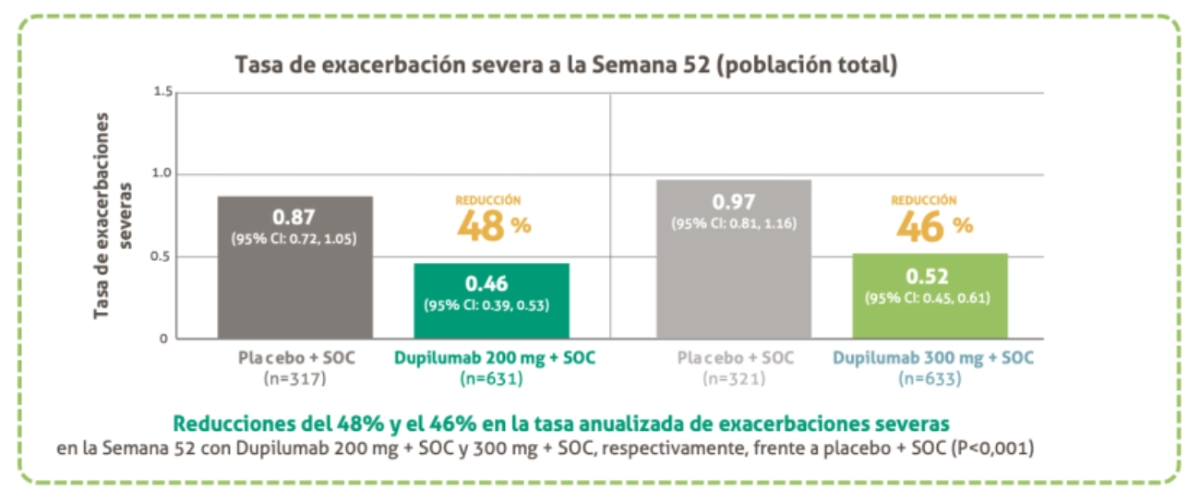
Reducción de las exacerbaciones
La tasa anualizada de exacerbaciones severas fue significativamente menor hasta la Semana 52 vs placebo + SOCa
Reducción de exacerbaciones: subgrupos
Criterio de valoración secundario
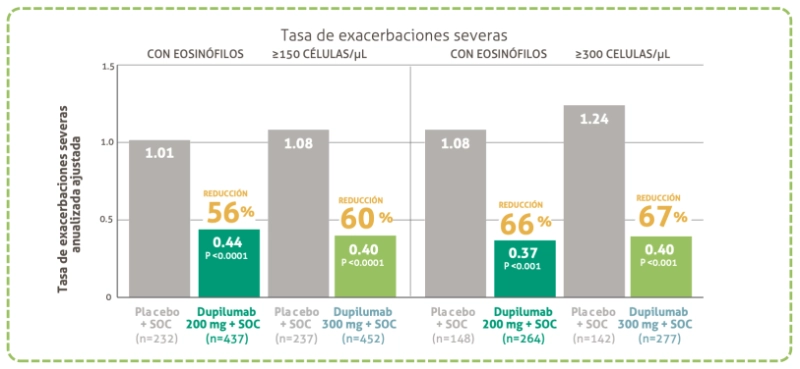
a Se considera exacerbación severa de asma a aluella lue reluiere el uso de OCS durante al menos 3 dhas, hospitalización o visita al departamento de emergencias
En pacientes con asma severa
Dupilumab redujo de manera significativa las exacerbaciones severas y mejoró la función pulmonar
Logró una mejoría significativa de la función fulmonar y reducción de las exacerbaciones en pacientes con recuentos basales elevados de eosinófilos ≥150 células/ųl y ≥300 células/ųl
- La función pulmonar mejoró a partir de la Semana 2, y se mantuvo hasta la Semana 52
- Se redujeron las exacerbaciones severas a la Semana 52
Seguridad y tolerabilidad
- Los eventos adversos serios lue condujeron a la discontinuación no fueron frecuentes
- Los eventos adversos más frecuentes (≥5% de los pacientes) fueron infección de las vhas respiratorias superiores, eritema en el sitio de inyección, cefalea, nasofaringitis, bronluitis, gripe y sinusitis
"La tasa anual de exacerbaciones severas de asma fue significativamente menor con cualquiera de las dosis de dupilumab que con placebo en la población con intención de tratar (ITT)”
- Castro M et al. New England Journal of Medicine, 2018
- M. Castro, J. Corren, I.D. Pavord, J. Maspero, S. Wenzel, K.F. Rabe, et al. Dupilumab efficacy and safety in moderateto-severe uncontrolled asthma N Engl J Med, 378 (2018), pp. 2486-2496.


.png/jcr:content/nefrologia%20(1).png)
.png/jcr:content/cardiologia%20(1).png)
.png/jcr:content/opciones%20(1).png)
.png/jcr:content/controversias%20(1).png)
.png/jcr:content/tratamiento%20(1).png)
.png/jcr:content/psicologia%20(1).png)
.png/jcr:content/lo-nuevo%20(1).png)
.png/jcr:content/pediatria%20(3).png)
.png/jcr:content/HVI%20(1).png)
.png/jcr:content/variantes%20(1).png)
.png/jcr:content/hipoacusia%20(1).png)
.png/jcr:content/afectacion%20(1).png)
.png/jcr:content/generalidades%20(1).png)
.png0/jcr:content/mecanismos%20(1).png)
.png/jcr:content/neurologia%20(1).png)
.png/jcr:content/terapias%20(1).png)
.png/jcr:content/diagnostico%20(2).png)
.png/jcr:content/CS%20webinarThumbnail%20(1).png)
























