Indikation
DUPIXENT är indicerat som tilläggsbehandling till intranasala kortikosteroider för behandling av vuxna med svår CRSwNP för vilka behandling med systemiska kortikosteroider och/eller kirurgi inte ger tillräcklig sjukdomskontroll.
CRS, kronisk rinosinuit; CRSwNP, kronisk rinosinuit med näspolyper.
| ADRESSERA typ 2 inflammation1-3 |
BEHANDLA hela spektrumet av symtom1,12,13 |
KONTROLLERA med mindre kirurgi eller orala kortikosteroider1,13 |
| Ta reda på hur > | Se data > | Läs mer > |
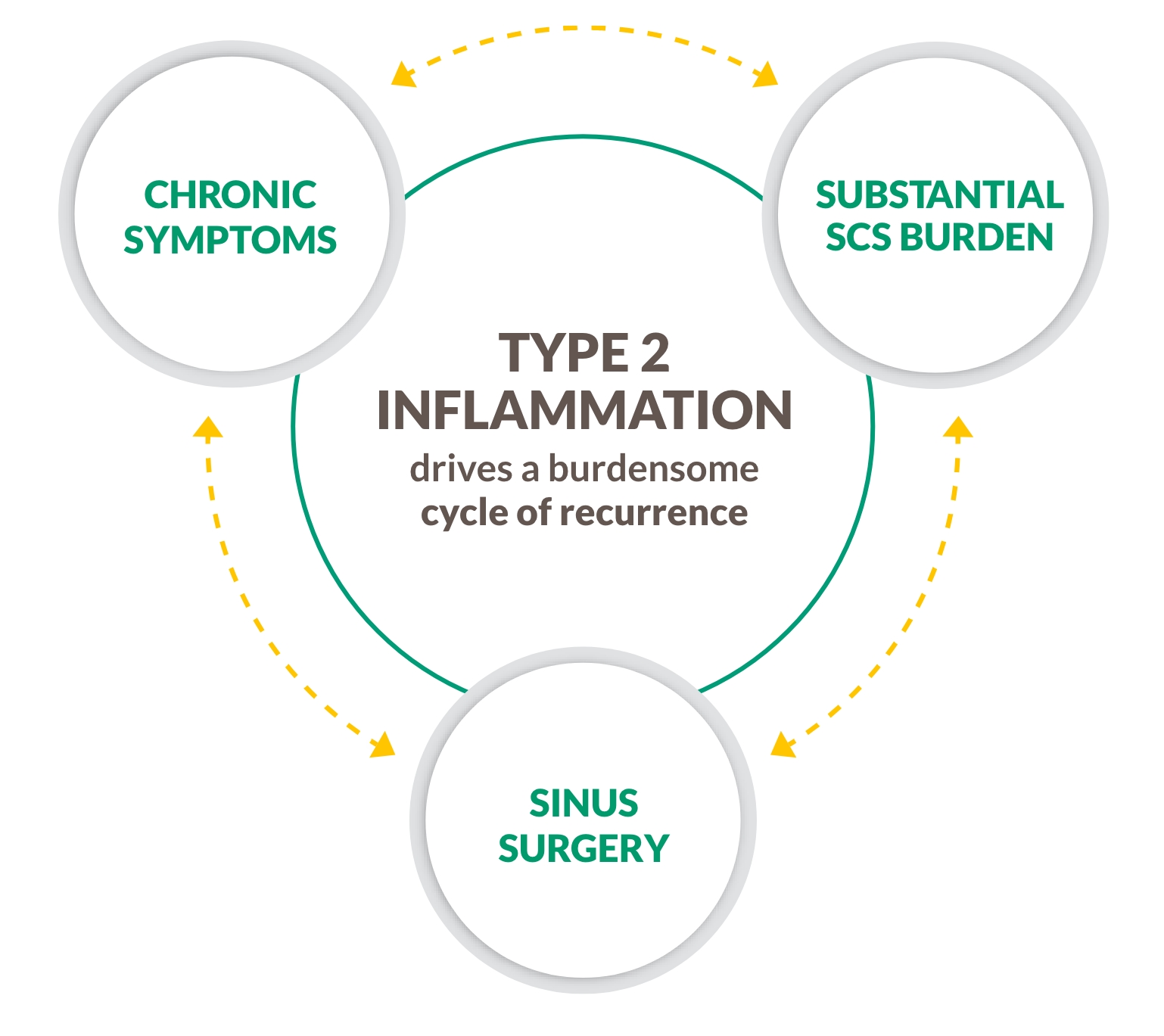
NP & Typ 2 inflammation
Otillfredsställda behov–Återfallscykel
CRSwNP är inte bara en obstruktiv sjukdom
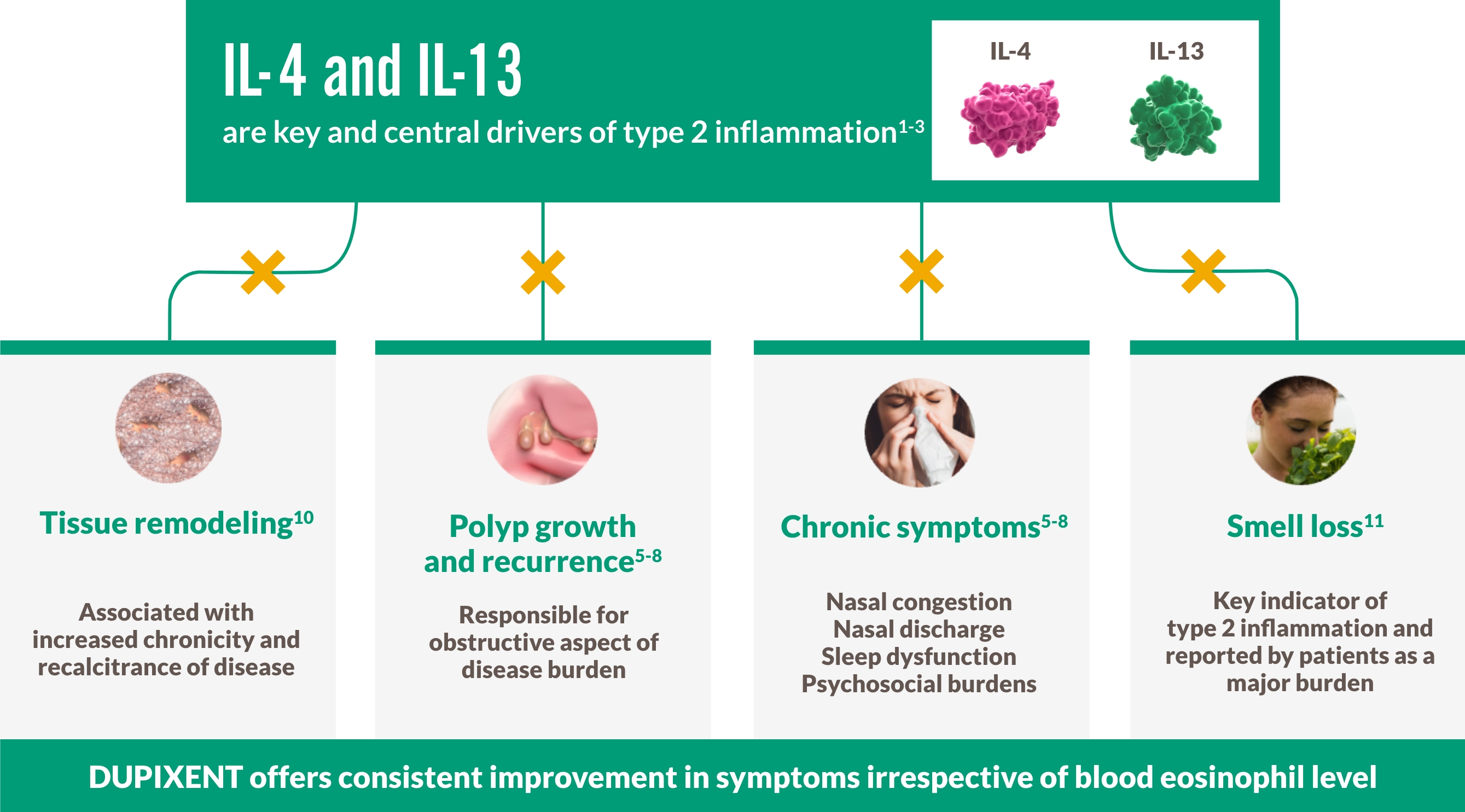
CRSwNP ÄR EN KRONISK TYP 2 INFLAMMATORISK SJUKDOM
~9 av 10 patienter med CRSwNP har Typ 2 inflammation, en underliggande orsak till komplikationer inklusive polypbildning4-9

BRYT CYKELN MED EN BIOLOGISK BEHANDLING SOM RIKTAR IN SIG MOT TYP 2 INFLAMMATION4-9
SCS, systemiska kortikosteroider.
Verkningsmekanismer
DUPIXENT RIKTAR IN SIG CENTRALT MOT UNDERLIGGANDE TYP 2 INFLAMMATION VID CRSwNP1-3
Effekt och data på sjukdomsbörda
Lukt
PATIENTER ÅTERFICK LUKTSINNET SÅ TIDIGT SOM DAG 312,a
DUPIXENT förbättrade luktförlust (LoS) så tidigt som dag 3, med en signifikant större andel patienter med luktsinne (UPSIT-poäng >18) jämfört med placebo vid vecka 24, vilket och bibehölls till och med vecka 52, hos patienter som fick INCS1,12-14
Förändring i UPSIT-poäng till och med vecka 52 i SINUS-52 (sekundärt utfallsmått)13
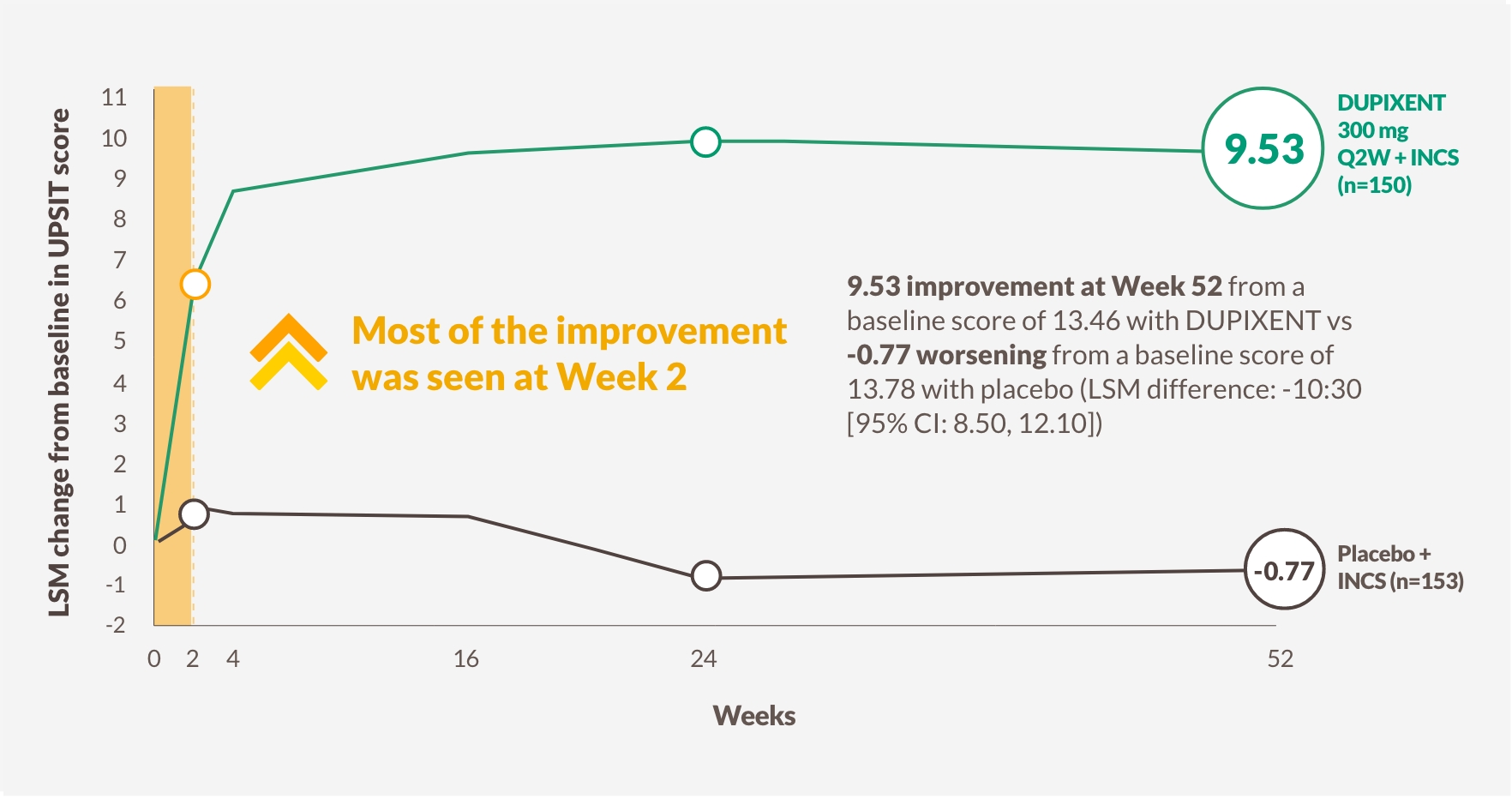
Figuren är reproducerad av Sanofi baserat på tabell S3C.13
a LSM-skillnad mellan DUPIXENT (n=438) och placebo (n=286): -0.07 (95% CI: -0.12, -0.02).
b 79% (n=228/287) av patienterna i den poolade armen som tog DUPIXENT 300 mg Q2W + INCS hade anosmi vid baslinjen, vilket reducerades till 30% (n=84/280) enligt UPSIT-poäng vid vecka 24.
Anosmi, UPSIT-poäng ≤18; INCS, intranasala kortikosteroider; LoS, luktförlustpoäng är ett självrapporterande mått av den dagliga svårighetsgraden av minskad eller förlorad lukt; LSM, minsta kvadratmedelvärde; Q2W, en gång varannan vecka; UPSIT, University of Pennsylvania Smell Identification Test.

2 AV 3 PATIENTER KUNDE IDENTIFIERA DOFTER IGEN VID VECKA 521,13,b
LUKTFÖRLUST ÄR ETT AV DE VIKTIGASTE SYMTOMEN FÖR PATIENTER
~9 av 10 patienter som har CRSwNP upplever luktförlust, vilket är korrelerat med ökad sjukdomssvårighet och kan vara det första tecknet i sjukdomens återfallscykel15-18
Luktförlust är starkt associerat med typ 2 inflammation15-18
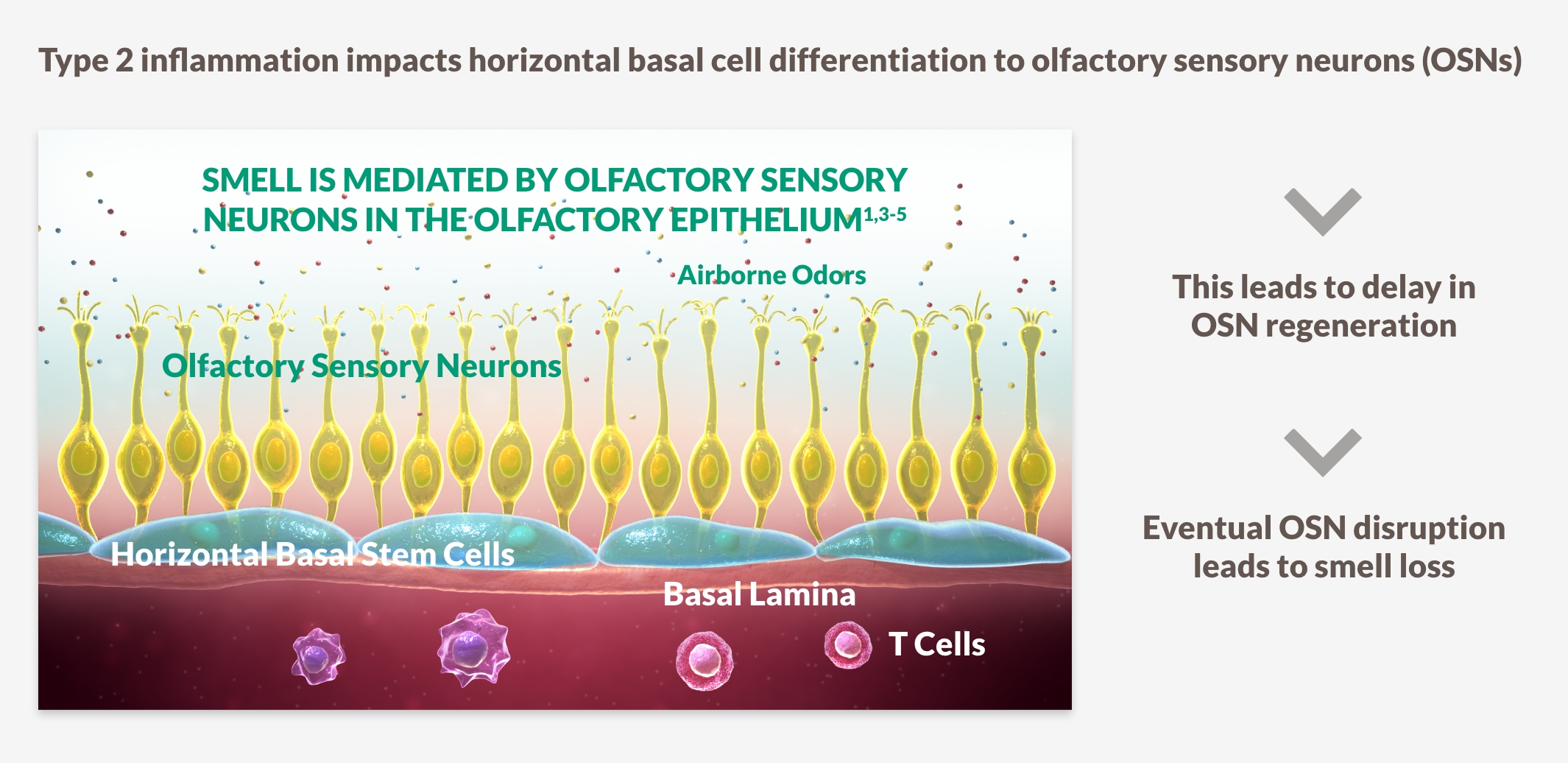

HÄMNING AV UNDERLIGGANDE MEKANISMER FÖR TYP 2 INFLAMMATION KAN SPELA EN ROLL I FÖRBÄTTRING AV LUKTSINNET15-18
NÄSTÄPPA
SNABB FÖRBÄTTRING AV NÄSTÄPPA VID DAG 2 SOM BIBEHÖLLS ÖVER 52 VECKOR1,12,13
DUPIXENT förbättrade NC-poäng jämfört med placebo så tidigt som dag 2, med signifikanta resultat vid vecka 24 som bibehölls till och med vecka 52 hos patienter som fick INCS1,12,13
Förändring i NC-poäng till och med vecka 52 i SINUS-52 (sekundärt utfallsmått)13
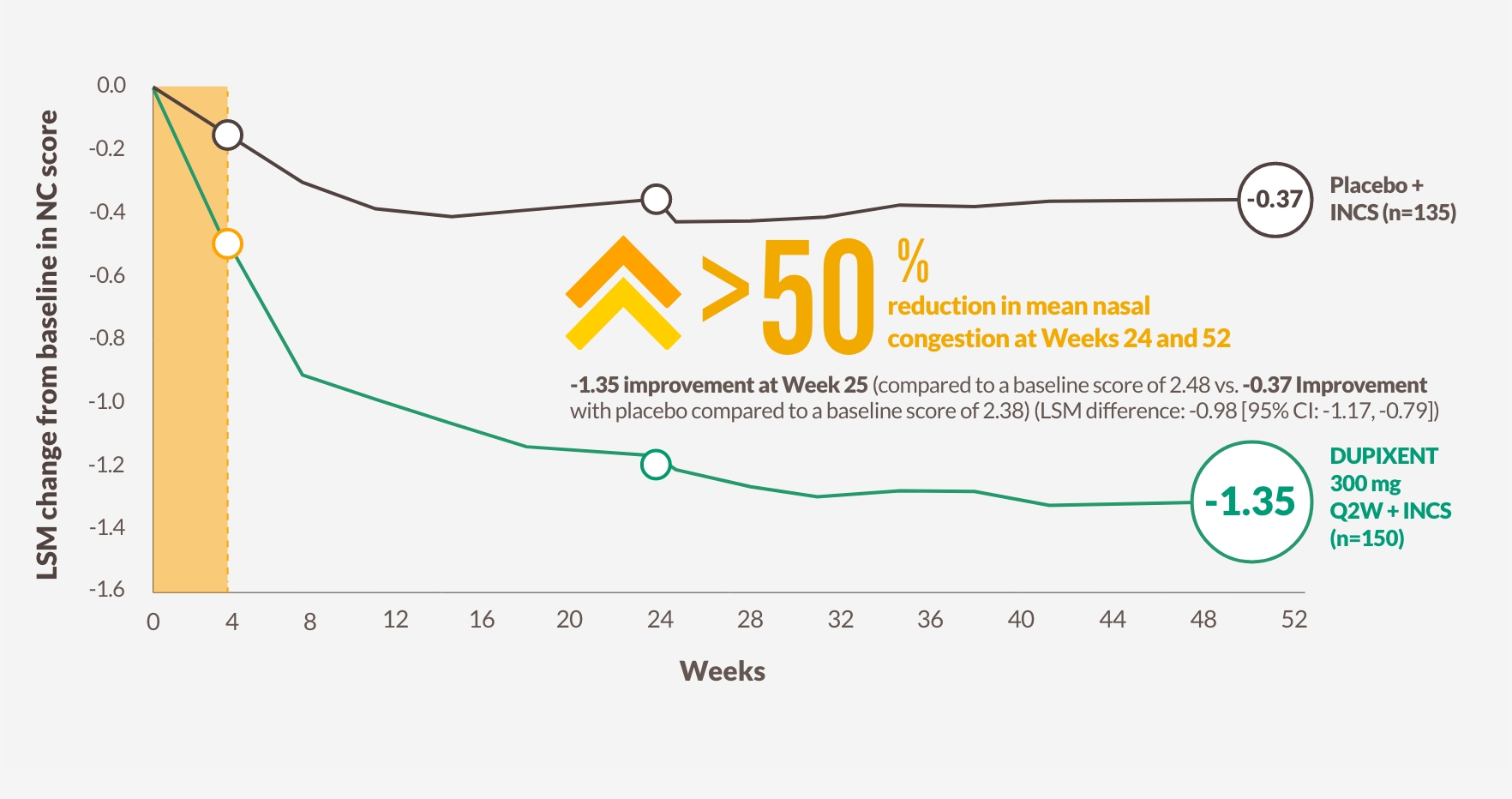
Figuren är reproducerad av Sanofi baserat på figur 2B13
-1.25 förbättring vid vecka 24 (koprimärt utfallsmått) från en baslinjepoäng på 2.46 med DUPIXENT 300 mg Q2W + INCS (n=295, poolade DUPIXENT-armar) jämfört med -0.38 förbättring från en baslinjepoäng på 2.38 med placebo + INCS (n=153) (LSM-skillnad: -0.87 [95% CI: -1.03, -0.71])1
HRQoL, hälsorelaterad livskvalitet; NC, nästäppa/obstruktion.
UNDERLIGGANDE TYP 2 INFLAMMATION KAN DRIVA NÄSTÄPPA OCH MINSKA LIVSKVALITETEN19
Nästäppa driver många fysiska, sociala och psykologiska besvär inom HRQoL relaterade till CRSwNP19
Effekter av nästäppa på HRQoL19 |
|
|
|

MÅNGA PATIENTER RAPPORTERADE FRUSTRATION ÖVER HANTERINGEN AV DERAS SYMPTOM19
Reduktion av kirurgi
MINDRE KIRURGI FÖR EN MAJORITET AV PATIENTERNA1,13
DUPIXENT minskade signifikant behovet av bihålekirurgi jämfört med placebo över 52 veckor hos patienter som fick INCS1,13

83% minskning av behovet av initial eller upprepad bihålekirurgi1,13
Från en förutbestämd poolad analys (dupilumab 300 mg Q2W [Arm A] och 300 mg Q2W–Q4W [Arm B] poolade; De första 24 veckorna endast för Arm B).2
100 mg MFNS i varje näsborre två gånger dagligen.2
Nässköljningar med koksaltlösning, systemisk antibiotika, kortvarig SCS eller sinonasal kirurgi tilläts vid behov under behandlings- och uppföljningsperioderna.13 Poolad placebo n=286, Poolad dupilumab n=438.
KIRURGI KAN FORTFARANDE LÄMNA PATIENTER I EN ÅTERFALLSCYKEL20-22
Trots att polypobstruktion åtgärdas, behandlar kirurgi inte den underliggande typ 2-inflammationen, som är associerad med sjukdomsbördan av CRS med näspolyper, inklusive ny polypbildning20-22
Bördor och begränsningar av kirurgi |
||
|
Med varje bihålekirurgi: |
||
|
Risken för revisionskirurgi ökar och tiden mellan operationerna minskar20 |
Bihålekirurgi behandlar inte luktförlust21 |
35% polypåterfall inom 6 månader, ökande över tid22 |

EPOS-RIKTLINJER ANSER ATT ETT MINSKAT BEHOV AV KIRURGI ÄR ETT KRITERIUM FÖR BIOLOGISKT BEHANDLING22
EPOS, European Position Paper on Rhinosinusitis and Nasal Polyps 2020.
Steroidreduktion
DUPIXENT RIKTAR SIG IN MOT TYP 2-INFLAMMATION OCH MINSKAR BEHOVET AV SYSTEMISKA STEROIDER1,13
DUPIXENT minskade signifikant behovet av systemiska steroider jämfört med placebo över 52 veckor hos patienter som fick INCS1,13

74% minskning av behovet av systemisk kortikosteroidanvändning1,13
Från en förutbestämd poolad analys (dupilumab 300 mg Q2W [Arm A] och 300 mg Q2W–Q4W [Arm B] poolade; endast de första 24 veckorna för Arm B).2
100 mg MFNS i varje näsborre två gånger dagligen.2
Nässköljningar med koksaltlösning, systemisk antibiotika, kortvarig SCS eller sinonasal kirurgi tilläts vid behov under behandlings- och uppföljningsperioderna.13
Poolad placebo n=286, Poolad dupilumab n=438.

DUPIXENT MINSKAR ELLER ELIMINERAR STEROIDBÖRDAN OAVSETT TIDIGARE KIRURGI1
KUMULATIV STEROIDANVÄNDNING ÖKAR DEN BETUNGANDE CYKELN PATIENTER STÅR INFÖR22-24
SCS-behandling riktar sig brett mot inflammation, och även kortvarig användning medför en risk för allvarliga biverkningar på kort och lång sikt22-24
Begränsningar av SCS-användning22-24 |
||
|
EPOS 2020-kriterierna råder att inte förskriva mer än två kurer av SCS per år på grund av de kumulativa biverkningarna. |
Risker med SCS-användning |
||
|

EPOS-RIKTLINJER ANSER ATT ETT MINSKAT BEHOV AV SCS ÄR ETT KRITERIUM FÖR BIOLOGISKT BEHANDLING22
NP-poäng
DEN ENDA BIOLOGISKA BEHANDLINGEN SOM RAPPORTERAR EN >2-POÄNGS FÖRBÄTTRING I FAS 3 STUDIER1,25,26
DUPIXENT minskade signifikant storleken på näspolyper jämfört med placebo mätt med bilateral endoskopisk NPS så tidigt som vecka 4, bibehållen till och med vecka 521,25,26
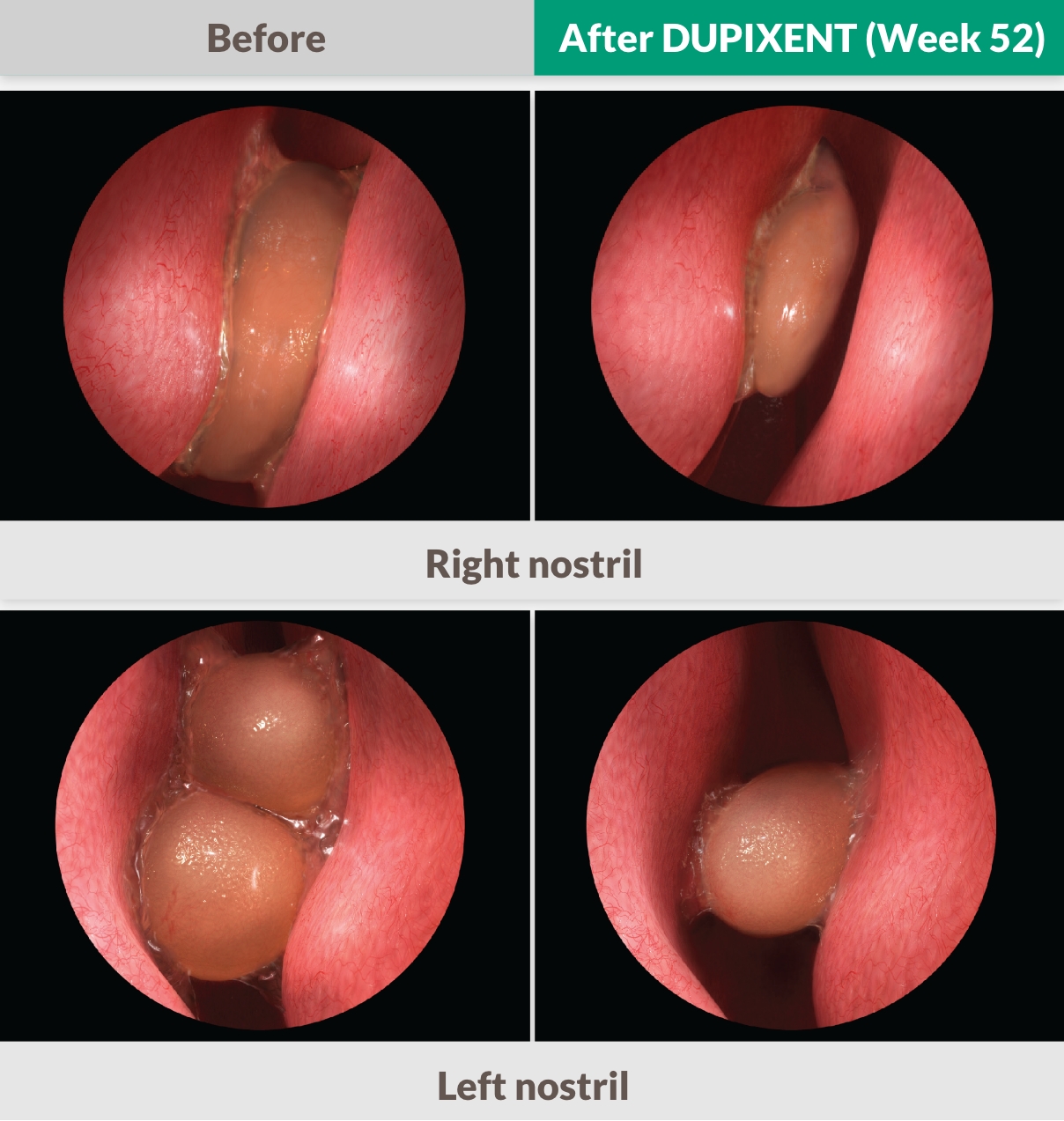
Endoskopibilder anpassade från faktiska SINUS-52 patienter. Individuella resultat varierade.

37% förbättring vid vecka 521,13
-1,71 förbättring vid vecka 24 (koprimärt utfallsmått) från en baslinjepoäng på 6,18 med DUPIXENT 300 mg Q2W + INCS (n=295, poolade DUPIXENT-armar) jämfört med 0,10 försämring från en baslinjepoäng på 5,96 med placebo + INCS (n=153) (LSM skillnad: -1,80 [95% CI: -2,10, -1,51])1
-2,24 förbättring vid vecka 52 från en baslinjepoäng på 6,07 (sekundärt utfallsmått) med DUPIXENT 300 mg Q2W + INCS (n=150) jämfört med 3% försämring med placebo + INCS (n=153) (0,15 från en baslinjepoäng på 5,96) (LSM skillnad: -2,40 [95% CI: -2,77, -2,02])1
NÄSPOLYPER ÄR EN MANIFESTATION AV CRS—TYP 2 INFLAMMATION ÄR EN UNDERLIGGANDE ORSAK11
Bilateral endoskopisk NPS kan hjälpa till att mäta polypbildning och återfall, vilket är nyckeltecken på typ 2 inflammation11,27,28
NPS-förbättring >2 indikerar betydande lindring av obstruktion27,28
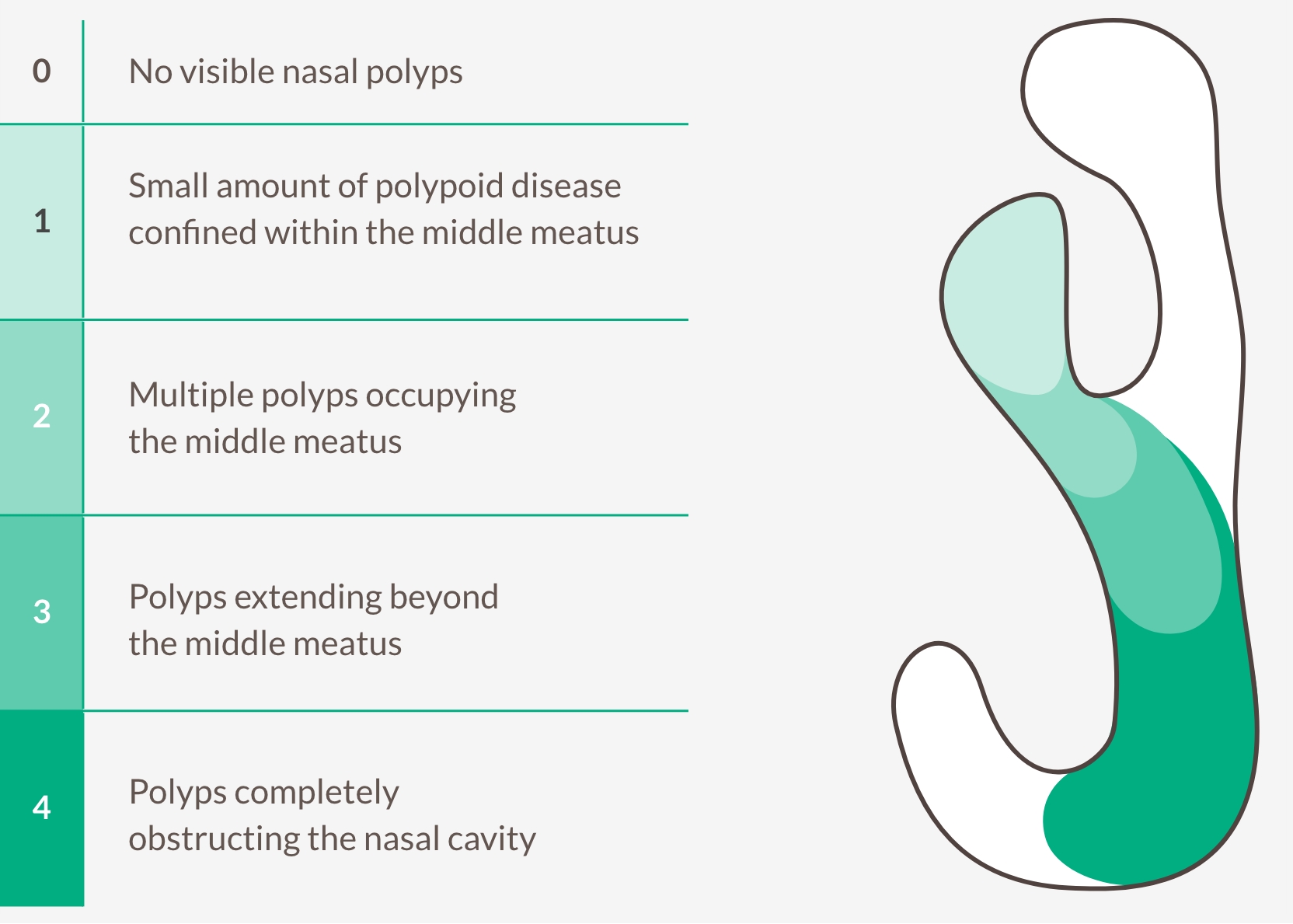

MÅLINRIKTA TYP 2 INFLAMMATION FÖR ATT MINSKA NÄSPOLYPSTORLEK OCH BEGRÄNSA ÅTERFALL11,27,28
Bilateral endoskopisk näspolypspoäng (NPS)
Centralt blindade avläsare graderar polyper i vänster och höger näsborre, intervall 0-4, och tilldelar en poäng baserat på summan av varje sida. Den maximala totala poängen är 8. Lägre poäng indikerar förbättring (mindre polyper).
LMK-CT
MÅLINRIKTA UNDERLIGGANDE TYP 2 INFLAMMATION FÖR ATT SE VARAKTIGA MINSKNINGAR I SINUSOPACIFIERING1
DUPIXENT minskade signifikant LMK-CT-poäng jämfört med placebo vid vecka 24, med större förbättring vid vecka 521
Baslinje vs Vecka 52
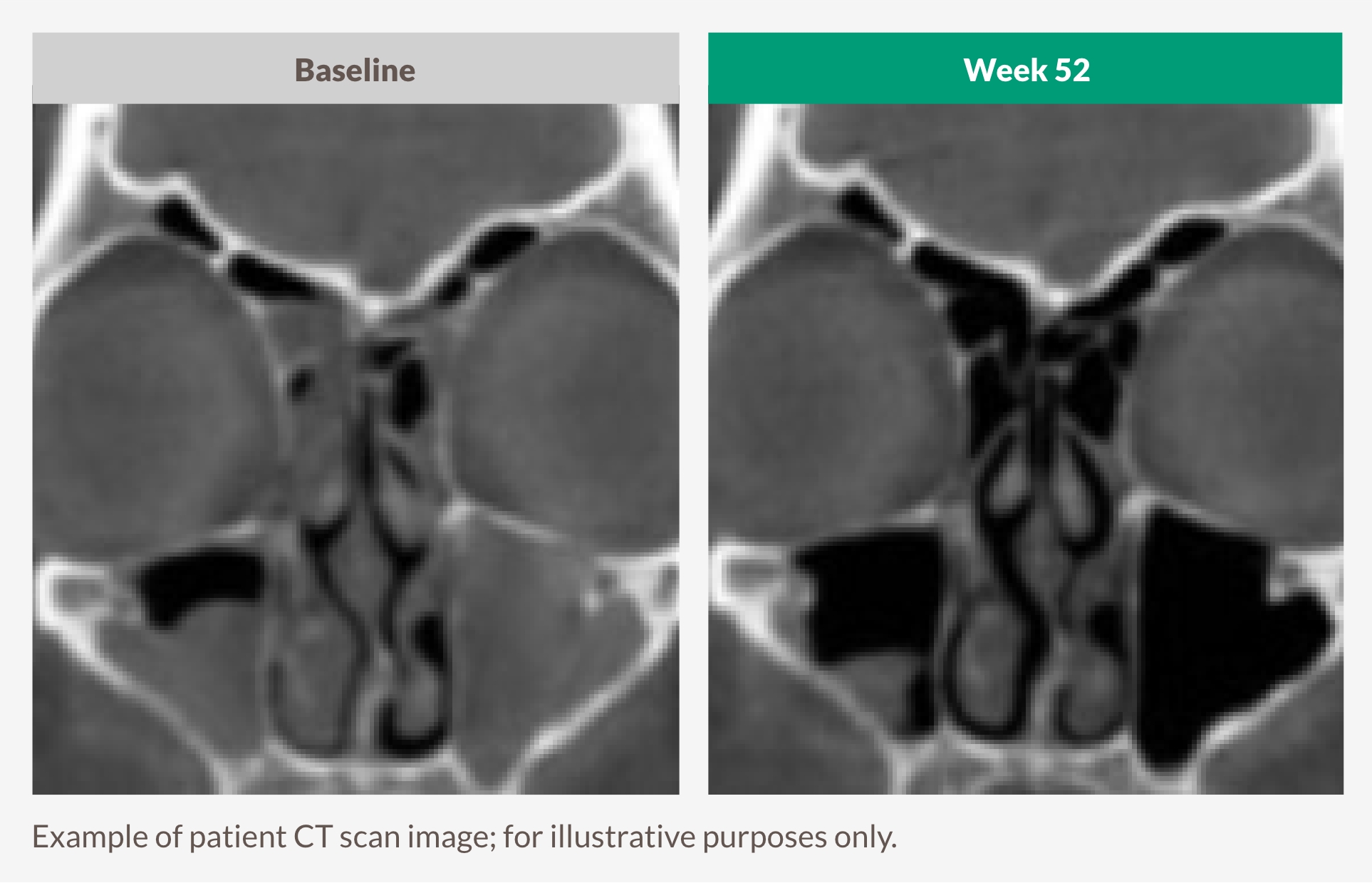

DET ENDA BIOLOGISKA LÄKEMEDLET SOM RAPPORTERAR LMK-CT-RESULTAT I DEN GODKÄNDA ETIKETTEN1,25,26
5,21 förbättring vid vecka 24 från en baslinjepoäng på 18,12 (sekundärt utfallsmått) med DUPIXENT 300 mg Q2W + INCS (n=295, poolade DUPIXENT-armar) jämfört med 0,09 förbättring (från en baslinjepoäng på 17,65) med placebo + INCS (n=153) (LSM skillnad: -5,13 [95% CI: -5,80, -4,46])1
6,83 förbättring vid vecka 52 från en baslinjepoäng på 18,42 (sekundärt utfallsmått) med DUPIXENT 300 mg Q2W + INCS (n=150) jämfört med 0,11 försämring från en baslinjepoäng på 17,65 med placebo + INCS (n=153) (LSM skillnad: -6,94 [95% CI: -7,87, -6,01])1
Lund-Mackay datortomografi-skanning (LMK-CT) poäng
Avläsaren bedömer CT-bilder av varje sinus och tilldelar en poäng från 0 (normal) till 2 (komplett opacificering). För alla sinussystem (förutom ostiomeatala komplexet) är den totala poängen summan från både höger och vänster sinus med ett maxpoäng på 24. Lägre poäng indikerar lägre opacifiering.
Sekundära utfallsmått
Livskvalitet
PATIENTER RAPPORTERADE FÖRBÄTTRADE SYMPTOM OCH HÄLSORELATERAD LIVSKVALITET1,13
DUPIXENT minskade signifikant SNOT-22-poängen jämfört med placebo så tidigt som vecka 4, bibehållen genom veckorna 24 och till och med 521,13
Förändring i SNOT-22-poäng genom vecka 52 i SINUS-5213
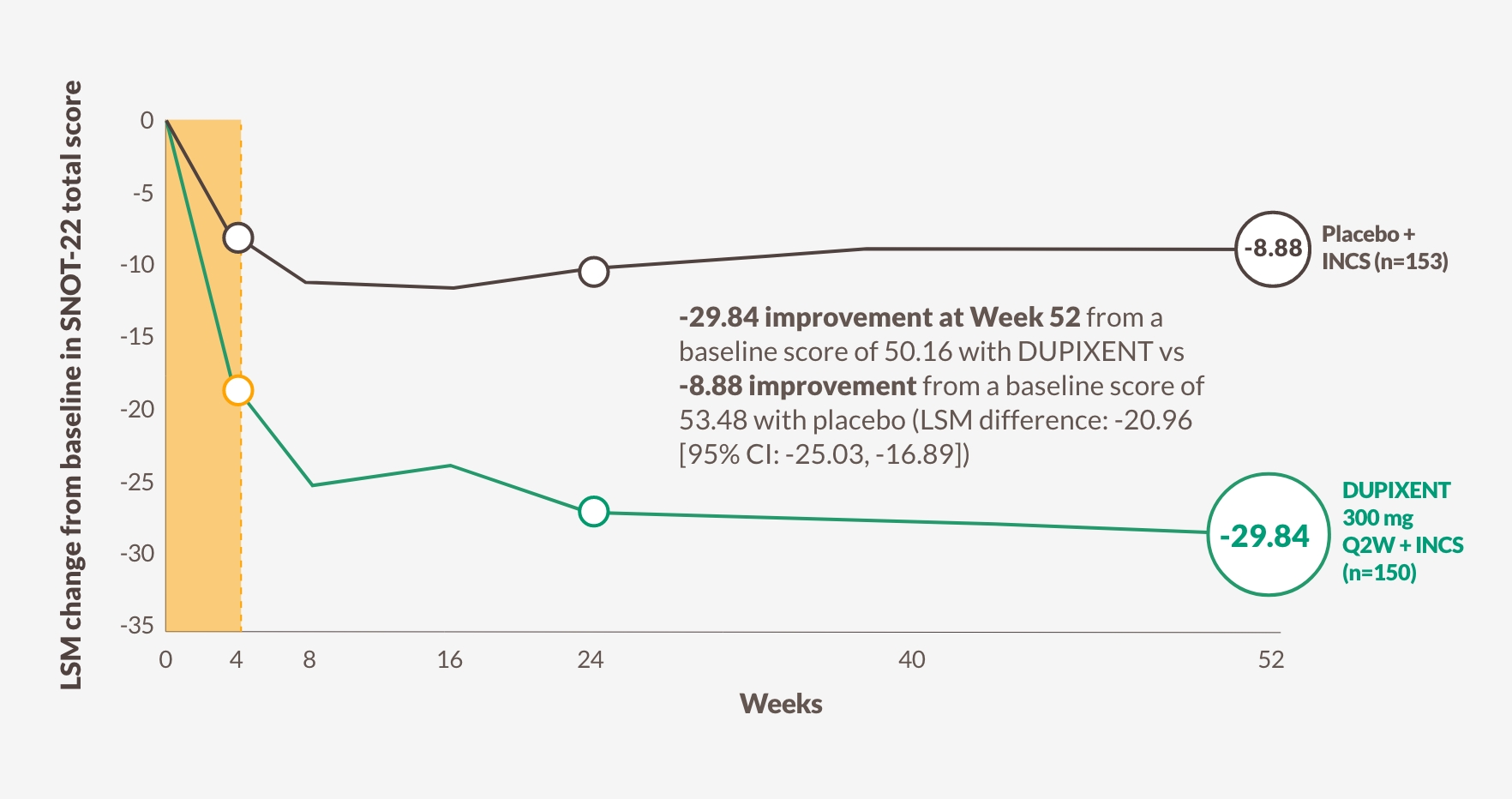
Figuren är reproducerad av Sanofi baserat på tabell S913

DUPIXENT FÖRBÄTTRADE UTFALL ENLIGT ETT SAMMANSATT POÄNGSYSTEM, INKLUSIVE FYSISKA SYMPTOM, SÖMN- OCH SÖMNRELATERADE BESVÄR, OCH PSYKOSOCIALA BEGRÄNSNINGAR1,13
SNOT-22-enkäten är en patientrapporterad bedömning av 22 symptom och konsekvenser av CRwNP, inklusive29: |
||
|
SNOT-22
Patienter bedömer 22 symptom och konsekvenser av CRSwNP. Den maximala poängen är 110.
Den meningsfulla kliniskt viktiga skillnaden är 8.9. Lägre poäng indikerar bättre hälsorealterad livskvalitet.
Samtidig astma
Hos patienter med CRSwNP och samtidig astma,
DUPIXENT FÖRBÄTTRADE ANDNINGEN OCH LIVSKVALITETEN13
DUPIXENT förbättrade lungfunktionen och astmakontrollen (ACQ-6) signifikant samtidigt som CRSwNP förbättrades13
Förändring i lungfunktion till och med vecka 24 i SINUS-5213
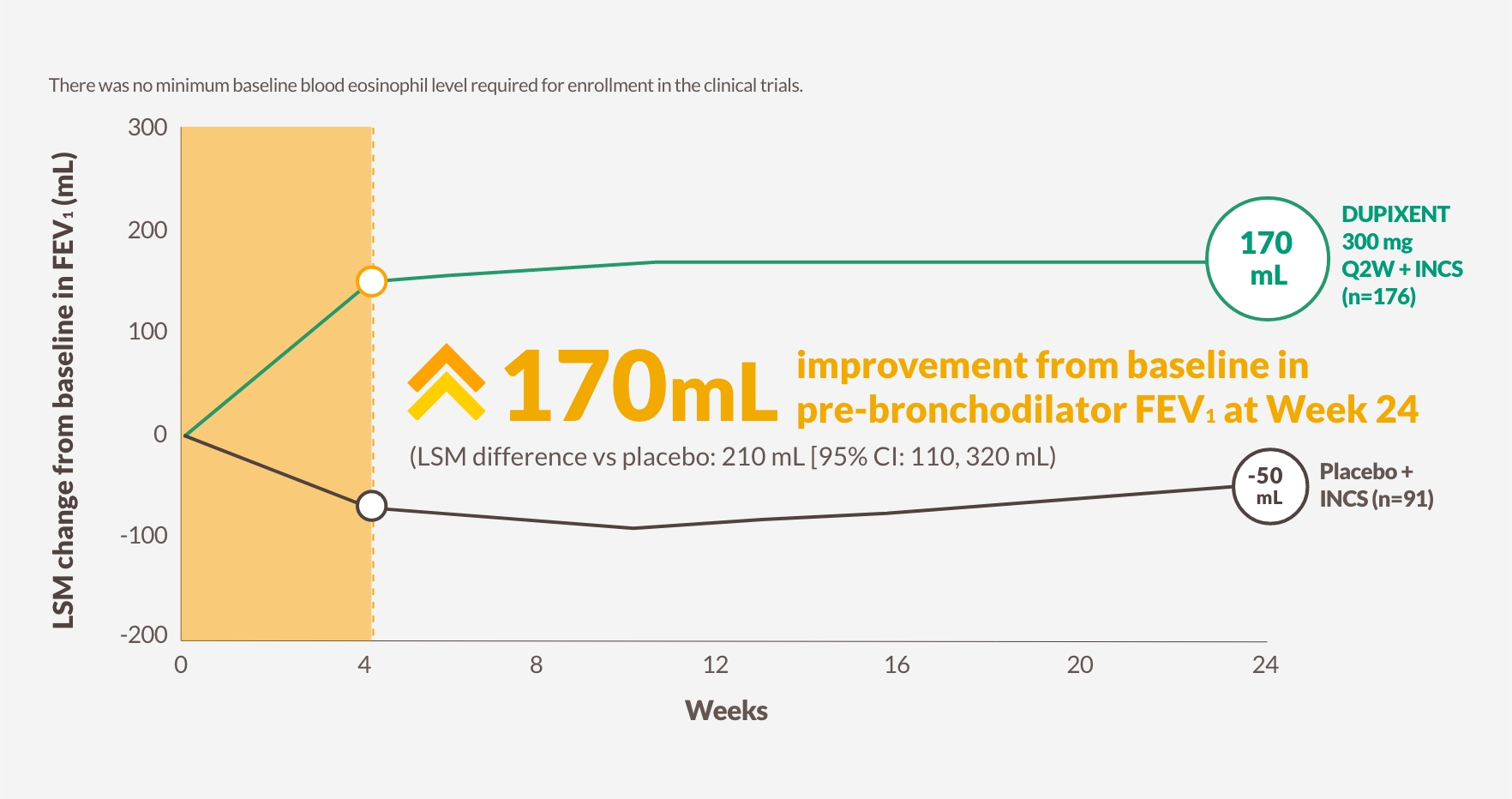
Figuren är reproducerad av Sanofi baserat på tabell S913
FEV1 före bronkdilatation
170 mL förbättring vid vecka 24 från baslinjen i FEV1 före bronkdilatation med DUPIXENT 300 mg Q2W + INCS (n=176, poolade DUPIXENT-armar) vs -50 mL försämring med placebo (LSM-skillnad vs placebo: 210 mL [95% CI: 110, 320 mL])13
ACQ-6
-0.78 förbättring vid vecka 24 från baslinjenpoäng i ACQ-6 på 1.55 med DUPIXENT 300 mg Q2W + INCS (n=176, poolade DUPIXENT-armar) vs 0.08 försämring från en baslinjepoäng på 1.63 med placebo (LSM-skillnad -0.87 [95% CI: -1.07, -0.66])13
ACQ-6, Frågeformulär astmakontroll, 6-frågeversion; FEV1, forcerad expiratorisk volym på 1 sekund.
Ett patientrapporterat mått på astmakontroll (5 frågor om symtom och 1 fråga om användning av behovsmedicinering). Maxpoängen är 6. Den kliniskt relevanta skillnaden är 0.5 poäng. Lägre poäng indikerar bättre astmakontroll.
DUPIXENT STUDERADES I DET STÖRSTA KLINISKA PRÖVNINGSPROGRAMMET FÖR CRSwNP1,a
Patienter inkluderades oavsett tidigare operation eller användning av systemiska kortikosteroider1
|
|
SINUS-24 (N=276) 24 Veckor |
SINUS-52 (N=448) 52 Veckor |
|
Randomiserad, fas 3-prövning |
DUPIXENT + INCS 300 mg Q2W i 24 veckor (n=143) Placebo + INCS i 24 veckor (n=133) |
DUPIXENT + INCS 300 mg Q2W i 52 veckor (n=150)b DUPIXENT + INCS 300 mg Q2W i 24 veckor, följt av Q4W genom vecka 52 (n=145)c Placebo + INCS i 52 veckor (n=153) |
|
Studiepopulation |
Vuxna (≥18 år) med CRSwNP på grundbehandling med INCS med tidigare sino-nasal kirurgi eller behandling med (eller som var olämpliga att få eller intoleranta mot) systemiska steroider de senaste 2 årend Patienter med kronisk rinosinuit utan näspolyper inkluderades inte i dessa prövningar Användning av systemiska kortikosteroider eller kirurgi tilläts under studiens gång om behov bedömdes föreligga enligt prövaren Den totala populationen av patienter i SINUS-24 och SINUS-52 begränsades inte baserat på kriterium av minsta värde av blodeosinofiler vid inklusion |
|
SINUS-24 Utvalda populationskarakteristiska: Män: 57%; medel CRSwNP varaktighet (SD): 11 (9) år; patienter med >1 tidigare operation: 72%; patienter med systemisk steroidanvändning de senaste 2 åren: 65%; medel bilateral endoskopisk NPS (SD), intervall 0-8: 5.8 (1.3); medel LMK sinus CT totalpoäng (SD), intervall 0-24: 19.0 (4.4); medel UPSIT-poäng (SD), intervall 0-40: 14.6 (8.5); medel luktförlustpoäng (AM) (SD), intervall 0-3: 2.7 (0.5); medel SNOT-22 totalpoäng (SD), intervall 0-110: 49.4 (20.2).1
SINUS-52 Utvalda populationskarakteristiska: Män: 62%; medel CRSwNP varaktighet (SD): 11 (10) år; patienter med >1 tidigare operation: 58%; patienter med systemisk steroidanvändning de senaste 2 åren: 80%; medel bilateral endoskopisk NPS (SD), intervall 0-8: 6.1 (1.2); medel LMK sinus CT totalpoäng (SD), intervall 0-24: 18.0 (3.8); medel UPSIT-poäng (SD), intervall 0-40: 13.6 (8.0); medel luktförlustpoäng (AM) (SD), intervall 0-3: 2.8 (0.5); medel SNOT-22 totalpoäng (SD), intervall 0-110: 51.9 (20.9).1
a Giltig från och med augusti 2023.
b I SINUS-52 är data från baslinjen till vecka 24 poolade DUPIXENT Q2W behandlingsarmar (n=295).
c Den rekommenderade dosen av DUPIXENT för vuxna patienter med CRSwNP är 300 mg subkutant varannan vecka.
d Alla patienter i placebo- och DUPIXENT-armarna var på en bakgrundsterapi av INCS, mometasonfuroat nässpray.
AM, morgon; Q4W, en gång var fjärde vecka; SD, standardavvikelse.
Patientprofiler
IDENTIFIERA TYP 2-INFLAMMATION HOS PATIENTER BEGRÄNSADE AV CRSwNP SYMTOM2,9
Leta efter tecken på typ 2-inflammation och ökad sjukdomsgrad för att bryta cykeln med hjälp av biologisk behandling2,9,30
De olika patienttyperna är representativa och är inte faktiska DUPIXENT-patienter.
Tecken på typ 2-inflammation inkluderar:2,9 |
||
|
Patientprofilerna är representativa och är inte faktiska DUPIXENT-patienter. AERD, Aspirin-Exacerbated Respiratory Disease
Säkerhet
DEN ETABLERADE SÄKERHETSPROFILEN BEKRÄFTADES TILL OCH MED VECKA 521
DUPIXENT är en fult human monoklonal antikropp med en säkerhetsprofil jämförbar med placebo1,a
|
Biverkningar i kliniska prövningar för CRSwNP, astma och atopisk dermatit1,a |
||
|
MedDRA System Organ Klass |
Frekvensb |
Biverkning |
|
Blod- och lymfsystemsjukdomar |
Vanlig |
Eosinofili |
|
Allmänna störningar och reaktioner vid administreringsstället |
Vanlig |
Reaktioner vid injektionsstället (inklusive erytem, ödem, klåda, smärta, svullnad och blåmärken)d |
|
Muskuloskeletala systemet och bindvävssjukdomar |
Vanlig |
Artralgiac |
|
Immunsystemsjukdomar |
Mindre vanlig |
Angioödemc |
|
Immunsystemsjukdomar |
Sällsynt |
Anafylaktisk reaktion, Serumsjukdomsreaktion, Serumsjukdomsliknande reaktion |
|
Hud- och subkutanvävnadssjukdomar |
Mindre vanlig |
Utslag i ansiktetc |
|
Biverkningar som förekommer främst i kliniska prövningar för atopisk dermatit |
||
|
Ögonsjukdomar |
Vanlig |
Allergisk konjunktivit |
|
Ögonsjukdomar |
Mindre vanlig |
Blefaritd |
|
Ögonsjukdomar |
Sällsynt |
Ulcerös keratitc,d |
|
Infektioner och infestationer |
Vanlig |
Konjunktivit |
I säkerhetspoolen var andelen patienter som avbröt behandlingen på grund av biverkningar:1
2,0% i DUPIXENT-gruppen
4,6% i placebogruppen

DUPIXENT ÄR INTE ETT IMMUNSUPPRESSIVT LÄKEMEDEL1
a DUPIXENT studerades i 12 randomiserade och, placebokontrollerade prövningar, inkluderat patienter med atopisk dermatit, astma och CRSwNP. De pivotala kontrollerade studierna involverade 4,206 patienter som fick dupilumab och 2,326 patienter som fick placebo under studiernas gång.
b Vanlig (≥1/100 till <1/10); mindre vanlig (≥1/1,000 till <1/100); sällsynt (≥1/10,000 till <1/1,000).
c Från eftermarknadsrapportering.
d Frekvenserna för ögonklåda, blefarit och torra ögon var vanliga och ulcerös keratit var mindre vanlig i studier för atopisk dermatit.
MedDRA, Medical Dictionary for Regulatory Activities.
Erfarenhet
DUPIXENT ANVÄNTS AV 1 MILJON PATIENTER VÄRLDEN ÖVER INOM ALLA INDIKATIONERa
Godkänd för 6 indikationer drivna av typ 2-inflammation1

Atopisk dermatit
okontrollerad svårb

Astma
svår typ 2 astma eller OCS-beroendec

CRSwNP
svår och otillräckligt kontrollerad

Prurigo nodularis
okontrollerad måttlig till svår

Eosinofil esofagit
otillräckligt kontrollerad

KOL
okontrollerad trots optimerad inhalationsterapid
ATOPISK DERMATIT
DUPIXENT är indicerat för behandling av måttlig till svår atopisk dermatit hos vuxna och ungdomar från 12 år och äldre som är lämpade för systemisk terapi. DUPIXENT är indicerat för behandling av svår atopisk dermatit hos barn från 6 månader till 11 år som är lämpade för systemisk terapi.
ASTMA
DUPIXENT är indicerat hos vuxna och ungdomar från 12 år och äldre som tilläggsbehandling för svår astma med typ 2-inflammation kännetecknad av förhöjda blod-eosinofiler och/eller förhöjd fraktion av utandad kväveoxid (FeNO), som är otillräckligt kontrollerad med hög dos inhalerade kortikosteroider (ICS) plus en annan medicinsk produkt för underhållsbehandling. DUPIXENT är indicerat hos barn från 6 till 11 år som tilläggsbehandling för svår astma med typ 2-inflammation kännetecknad av förhöjda blod-eosinofiler och/eller förhöjd fraktion av utandad kväveoxid (FeNO), som är otillräckligt kontrollerad med medelhög till hög dos inhalerade kortikosteroider (ICS) plus en annan medicinsk produkt för underhållsbehandling.
CRSwNP
DUPIXENT är indicerat som tilläggsbehandling med intranasala kortikosteroider för behandling av vuxna med svår CRSwNP för vilka behandling med systemiska kortikosteroider och/eller kirurgi inte ger tillräcklig sjukdomskontroll.
PRURIGO NODULARIS (PN)
DUPIXENT är indicerat för behandling av vuxna med måttlig till svår PN som är lämpade för systemisk terapi.
EOSINOFIL ESOFAGIT (EoE)
DUPIXENT är indicerat för behandling av eosinofil esofagit hos vuxna och ungdomar från 12 år och äldre, som väger minst 40 kg, som är otillräckligt kontrollerade av, är intoleranta mot, eller som inte är kandidater för konventionell medicinsk terapi.
KRONISK OBSTRUKTIV LUNGSJUKDOM (KOL)
Dupixent är indicerat hos vuxna som tilläggsbehandling för okontrollerad kroniskt obstruktiv lungsjukdom (KOL), kännetecknad av förhöjda blod-eosinofiler, på en kombination av en inhalerad kortikosteroid (ICS), en långverkande beta2-agonist (LABA), och en långverkande muskarinantagonist (LAMA), eller på en kombination av en LABA och en LAMA om ICS inte är lämplig.
För ytterligare information, klicka här för SmPC.
a Världen över inom 6 indikationer.
b Hos patienter i åldern 6 månader till 11 år är DUPIXENT indicerat för svår atopisk dermatit, och DUPIXENT är indicerat för måttlig till svår atopisk dermatit hos patienter 12+ år.1
c Typ 2 astmapatienter identifierade genom förhöjda nivåer av typ 2-biomarkörer eller OCS-beroende patienter enligt GINA-riktlinjer.
d Trippel inhalationsterapi, eller dubbel inhalationsterapi om ICS inte är lämplig1
GINA, Global Initiative for Asthma; OCS, oral kortikosteroid.
Dosering1
DUPIXENT KAN ADMINISTRERAS BÅDE HEMMA- OCH PÅ KLINIK1
Rekommenderad dosering för patienter med okontrollerad CRSwNP1
|
18+ ÅR |
300 mga |
varannan vecka |
INGEN LADDNINGSDOS |
Utformad med patienterna i åtanke. DUPIXENT har 2 alternativ för självadministration1 |
|
Förfylld Spruta |
Förfylld Penna |
|
|
|
|
|
DUPIXENT är avsedd att användas under vägledning av en vårdgivare. En patient kan själv injicera DUPIXENT efter utbildning i subkutan injektionsteknik med hjälp av den förfyllda sprutan eller den förfyllda pennan. Ge korrekt utbildning till patienter och/eller vårdgivare om förberedelse och administration av DUPIXENT före användning enligt bruksanvisningen.1
DUPIXENT kan administreras på klinik under vägledning av en vårdgivare om patienten inte är en lämplig kandidat för självadministration.1
a 300 mg/2 mL lösning.
Referenser
1. DUPIXENT Summary of Product Characteristics, 2025.
2. Gandhi NA, Bennet BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50. doi:10.1038/nrd4624
3. Schleimer RP. Immunopathogenesis of chronic rhinosinusitis and nasal polyposis. Annu Rev Pathol. 2017;12:331-357. doi:10.1146/annurev-pathol- 052016-100401
4. Stevens WW, Peters AT, Tan BK, et al. Associations between inflammatory endotypes and clinical presentations in chronic rhinosinusitis. J Allergy Clin Immunol Pract. 2019;7(8):2812-2820.e3. doi:10.1016/j.jaip.2019.05.009
5. Maspero J, Adir Y, Al-Ahmad M, et al. Type 2 inflammation in asthma and other airway diseases. ERJ Open Res. 2022;8(3):00576-2021. doi:10.1183/23120541.00576-2021
6. Dietz de Loos DA, Hopkins C, Fokkens WJ. Symptoms in chronic rhinosinusitis with and without nasal polyps. Laryngoscope. 2013;123(1):57-63. doi:10.1002/lary.23671
7. Tsunemi Y, Nakayama T, Kashiwagi T, Akutsu M, Saito S, Haruna S. Long-term efficacy of dupilumab for eosinophilic chronic rhinosinusitis. Am J Rhinol Allergy. 2024;38(1):14-22. doi:10.1177/19458924231204128
8. Han JK, Bosso JV, Cho SH, et al. Multidisciplinary consensus on a stepwise treatment algorithm for management of chronic rhinosinusitis with nasal polyps. Int Forum Allergy Rhinol. 2021;11(10):1407-1416. doi:10.1002/alr.22851
9. De Corso E, Baroni S, Settimi S, et al. Sinonasal biomarkers defining type 2-high and type 2-low inflammation in chronic rhinosinusitis with nasal polyps. J Pers Med. 2022;12(8):1251. doi:10.3390/jpm12081251
10. Amirapu S, Biswas K, Radcliff FJ, Wagner Mackenzie B, Ball S, Douglas RG. Sinonasal tissue remodelling during chronic rhinosinusitis. Int J Otolaryngol. 2021;2021:7428955. doi:10.1155/2021/7428955
11. Ferguson BJ, Rizk H, Ramakrishnan J, Pant H. Categorization of nasal polyps. In: Önerci TM, Ferguson BJ, eds. Nasal Polyposis. Springer-Verlag; 2010:103-110.
12. Hellings PW, Peters AT, Chaker AM, et al. Rapid and sustained effects of dupilumab in severe chronic rhinosinusitis with nasal polyps. Int Forum Allergy Rhinol. 2022;12(7):958-962. doi:10.1002/alr.22944
13. Bachert C, Han JK, Desrosiers M, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallelgroup phase 3 trials. Lancet. 2019;394(10209):1638-1650. doi:10.1016/S0140- 6736(19)31881-1
14. Canonica GW, Bourdin A, Peters AT, et al. Dupilumab demonstrates rapid onset of response across three type 2 inflammatory diseases. J Allergy Clin Immunol Pract. 2022;10(6):1515-1526. doi:10.1016/j.jaip.2022.02.026
15. Yan X, Whitcroft LK, Hummel T. Olfaction: sensitive indicator of inflammatory burden in chronic rhinosinusitis. Laryngoscope Investig Otolaryngol. 2020;5(6):992-1002. doi:10.1002/lio2.485
16. Chen M, Reed RR, Lane AP. Chronic inflammation directs an olfactory stem cell functional switch from neuroregeneration to immune defense. Cell Stem Cell. 2019;25(4):501-513.e5. doi:10.1016/j.stem.2019.08.011
17. Rouyar A, Classe M, Gorski R, et al. Type 2/Th2-driven inflammation impairs olfactory sensory neurogenesis in mouse chronic rhinosinusitis model. Allergy. 2019;74(3):549-559. doi:10.1111/all.13559
18. Mullol J, Mariño-Sánchez F, Valls M, Alobid I, Marin C. The sense of smell in chronic rhinosinusitis. J Allergy Clin Immunol. 2020;145(3):773-776. doi:10.1016/j.jaci.2020.01.024
19. Bachert C, Bahattacharyya N, Desrosiers M, Khan AH. Burden of disease in chronic rhinosinusitis with nasal polyps. J Asthma Allergy. 2021;14:127-134. doi:10.2147/JAA.S290424
20. DeConde AS, Mace JC, Levy JM, Rudmik L, Alt JA, Smith TL. Prevalence of polyp recurrence after endoscopic sinus surgery for chronic rhinosinusitis with nasal polyposis. Laryngoscope. 2017;127(3):550-555. doi:10.1002/lary.26391
21. De Corso E, Settimi S, Montuori C, et al. How to manage recurrences after surgery in CRSwNP patients in the biologic era: a narrative review. Acta Otorhinolaryngol Ital. 2023;43(2)(suppl 1):S3-S13. doi:10.14639/0392-100X-suppl.1-43-2023-01
22. Fokkens WJ, Viskens AS, Backer V, et al. EPOS/EUFOREA update on indication and evaluation of biologics in chronic rhinosinusitis with nasal polyps 2023. Rhinology. 2023;61(3):194-202. doi:10.4193/Rhin22.489
23. Hellings PW, Alobid I, Anselmo-Lima WT, Bernal- Sprekelsen M, Bjermer L, Caulley L, Chaker A, Constantinidis J, Conti DM, De Corso E, Desrosiers M. EUFOREA/EPOS2020 statement on the clinical considerations for chronic rhinosinusitis with nasal polyps care. Allergy. 2024 May;79(5):1123-33.
24. Hox V, Lourijsen E, Jordens A, et al. Benefits and harm of systemic steroids for short- and long-term use in rhinitis and rhinosinusitis: an EAACI position paper. Clin Transl Allergy. 2020;10:1. doi:10.1186/s13601-019-0303-6
25. XOLAIR Summary of Product Characteristics, 2020.
26. NUCALA Summary of Product Characteristics, 2021.
27. Han JK, Bachert C, Lee SE, et al. Estimating clinically meaningful change of efficacy outcomes in inadequately controlled chronic rhinosinusitis with nasal polyposis. Laryngoscope. 2022;132(2):265-271. doi:10.1002/lary.29888
28. Gelardi M, Bocciolini C, Notargiacomo M, et al. Chronic rhinosinusitis with nasal polyps: how to identify eligible patients for biologics in clinical practice. Acta Otorhinolaryngol Ital. 2022;42(1):75-81. doi:10.14639/0392-100X-N1699
29. Asiri M, Alokby G. Validation and cross-cultural adaptation of the Sinonasal Outcome Test (SNOT)-22 for the Arabian patient population. Cureus. 2019;11(4):e4447.doi:10.7759/cureus.4447
30. Mullol J, Bachert C, Amin N, et al. Olfactory outcomes with dupilumab in chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol Pract. 2022:1086-1095.e5. doi:10.1016/j.jaip.2021.09.037

© 2024 Sanofi and Regeneron Pharmaceuticals. Inc. All Rights Reserved.
MAT-BE-2400891 V1.0 MAY 2025